
科目:gzhx 来源: 题型:
用0.2mol/L某金属阳离子Rn+的盐溶液40mL,恰好将20mL0.4mol/L的硫酸盐中的硫酸根完全沉淀,则n值为
A.1 B.2 C.3 D.4
科目:gzhx 来源:学习周报 化学 人教课标高一版(必修1) 2009-2010学年 第3期 总第159期 人教课标版 题型:013
|
浓度为 0.50 mol/L某金属阳离子Mn+的溶液10.00 mL,与0.40 mol/L NaOH溶液12.50 mL恰好完全反应生成沉淀,则n等于 | |
| [ ] | |
A. |
1 |
B. |
2 |
C. |
3 |
D. |
4 |
科目:gzhx 来源: 题型:单选题
科目:gzhx 来源: 题型:
| A、1 | B、2 | C、3 | D、4 |
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:阅读理解
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液 的体积(mL) |
20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度 (mol•L-1) |
0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
科目:gzhx 来源: 题型:阅读理解
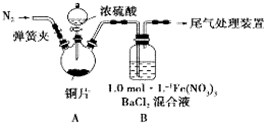 我省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究.
我省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3 溶液的反应[0.1mol/L的Fe(NO3)3 溶液的 pH=2]做了相应探究.科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:

| O | - 3 |
科目:gzhx 来源: 题型:
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
科目:gzhx 来源: 题型:
科目:gzhx 来源:2014届湖北荆门高二上学期期末教学质量检测化学试卷(解析版) 题型:选择题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),平衡时体系中c(Pb2+)和c(Sn2+)的浓度分别为
Sn2+(aq)+Pb(s),平衡时体系中c(Pb2+)和c(Sn2+)的浓度分别为
0.1 mol/L和0.2mol/L。下列判断正确的是
A.25℃时,该反应的平衡常数K=0.2
B.往平衡体系中加入金属铅后,c(Pb2+)增大
C.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变大
D.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
科目:gzhx 来源:2011-2012学年吉林省吉林一中高二下学期期中考试化学试卷(带解析) 题型:计算题
(7分)已知由某一元羧酸与甲醇生成的酯,该酯不能使溴水褪色,分子中只有一个环状结构,取0.68g该酯与40mL 0.2mol/L的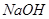 溶液混合加热,使其完全水解后,再用0.2mol/L的盐酸中和剩余的碱,耗去15mL盐酸。另取27.2g该酯,完全燃烧后得到70.4g
溶液混合加热,使其完全水解后,再用0.2mol/L的盐酸中和剩余的碱,耗去15mL盐酸。另取27.2g该酯,完全燃烧后得到70.4g 和14.4g水。
和14.4g水。
求:(1)该酯的相对分子质量
(2)确定该酯的分子式,结构简式和名称。
科目:gzhx 来源:2013届吉林省高二下学期期中考试化学试卷(解析版) 题型:计算题
(7分)已知由某一元羧酸与甲醇生成的酯,该酯不能使溴水褪色,分子中只有一个环状结构,取0.68g该酯与40mL 0.2mol/L的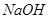 溶液混合加热,使其完全水解后,再用0.2mol/L的盐酸中和剩余的碱,耗去15mL盐酸。另取27.2g该酯,完全燃烧后得到70.4g
溶液混合加热,使其完全水解后,再用0.2mol/L的盐酸中和剩余的碱,耗去15mL盐酸。另取27.2g该酯,完全燃烧后得到70.4g 和14.4g水。
和14.4g水。
求:(1)该酯的相对分子质量
(2)确定该酯的分子式,结构简式和名称。
科目:gzhx 来源: 题型:
A.1 B.2 C.3 D.4
科目:gzhx 来源:2012届江苏省扬州中学高三下学期质量检测(三)化学试卷(带解析) 题型:实验题
(12分)某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应生成沉淀的离子),Cl―即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。请回答下列问题:
(1)滴定反应达到终点的现象是 ;
(2)实施滴定的溶液以呈 (选填“酸性”、“中性”或“碱性”)为宜,加
(填化学式)试剂可达到这一目的;
(3)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n (Clˉ)的测定结果 (选填“偏高”、“偏低”或“无影响”);
(4)到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,否则这种误差会使n (Clˉ)测定值偏低,这说明两者的溶解度:AgCl AgSCN(填“>”或“<”);
(5)若以Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液20.0mL,则原氯化锶样品的纯度为 。
科目:gzhx 来源:2012-2013学年湖北荆门高二上学期期末教学质量检测化学试卷(带解析) 题型:单选题
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),平衡时体系中c(Pb2+)和c(Sn2+)的浓度分别为
Sn2+(aq)+Pb(s),平衡时体系中c(Pb2+)和c(Sn2+)的浓度分别为
0.1 mol/L和0.2mol/L。下列判断正确的是
| A.25℃时,该反应的平衡常数K=0.2 |
| B.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| C.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变大 |
| D.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
科目:gzhx 来源:2011-2012学年江苏省高三下学期质量检测(三)化学试卷(解析版) 题型:实验题
(12分)某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应生成沉淀的离子),Cl―即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。请回答下列问题:
(1)滴定反应达到终点的现象是 ;
(2)实施滴定的溶液以呈 (选填“酸性”、“中性”或“碱性”)为宜,加
(填化学式)试剂可达到这一目的;
(3)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n (Clˉ)的测定结果 (选填“偏高”、“偏低”或“无影响”);
(4)到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,否则这种误差会使n (Clˉ)测定值偏低,这说明两者的溶解度:AgCl AgSCN(填“>”或“<”);
(5)若以Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液20.0mL,则原氯化锶样品的纯度为 。
科目:gzhx 来源: 题型:
A.1 B.2 C.3 D.4