小雅同学通过学习,对空气和氧气有了一定的了解:
A.工业制氧气的原理是分离液态空气,其方法是首先将空气通过
加压降温
加压降温
处理后转化成液态空气,然后略微升温就可以使其中的
氮气
氮气
(填“氧气”或“氮气”)先逸出.(已知氧气的沸点是-183℃,氮气的沸点是-196℃)
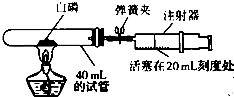
B.为验证空气中氧气的含量,小雅同学选用40mL的试管和量程足够大且润滑效果很好的注射器等作器材(如图).将足量的比红磷更易燃烧的白磷放入试管,用橡皮塞塞紧管口,夹紧弹簧夹.点燃酒精灯,使白磷在试管中燃烧(产物为五氧化二磷),燃烧结束待试管冷却后松开弹簧夹,观察现象.
(1)实验开始前,小雅打开弹簧夹,将注射器活塞从20mL刻度处推至15mL处,然后松开活塞,观察到
活塞退回20mL刻度
活塞退回20mL刻度
的现象,说明该装置气密性良好.
(2)实验中,在松开弹簧夹前,试管中可以观察到白磷燃烧发出黄色火焰,放出大量热并产生
大量白烟
大量白烟
.
(3)实验后,可以观察到注射器活塞会从原来的20mL刻度处慢慢向左移到约
③
③
处(橡皮管内空气忽略不计).
①.4mL刻度 ②.8mL刻度 ③.12mL刻度 ④.16mL刻度
(4)如果装置中没有弹簧夹,重复该实验,则在整个实验中,注射器活塞
先向右后向左
先向右后向左
移动,最后停留在约
8
8
mL处(橡皮管内空气忽略不计).
C.实验室中检验氧气时小雅发现:收集的氧气占集气瓶容积的70%(空气占30%)时,能使带火星的木条复燃.那么,使带火星的木条复燃的氧气浓度的最低值是多少呢?
小雅对此展开探究:
第一组实验:取5只集气瓶,编号为①、②、③、④、⑤,分别装入其总容积10%、20%、30%、40%、50%的水.用排水法收集氧气,恰好把5只集气瓶中的水排去.将带火星的木条依次插入①~⑤号瓶中,记录实验现象.
小雅在第一组实验的基础上又做了第二组和第三组实验,数据和现象见下表.
|
第一组 |
第二组 |
第三组 |
| 集气瓶编号 |
① |
② |
③ |
④ |
⑤ |
① |
② |
③ |
④ |
⑤ |
① |
| 收集的O2占容积的体积分数(%) |
10 |
20 |
30 |
40 |
50 |
3l |
33 |
35 |
37 |
39 |
34 |
| 带火星木条的 状况 |
微亮 |
亮 |
很亮 |
复燃 |
复燃 |
很亮 |
很亮 |
复燃 |
复燃 |
复燃 |
很亮 |
请根据实验回答下列问题:
收集的氧气占容积的体积分数最低为
35
35
%时,可使带火星的木条复燃,这时集气瓶中氧气体积分数是
49或48
49或48
%(计算结果保留整数).

 小雅同学通过学习,对空气和氧气有了一定的了解:
小雅同学通过学习,对空气和氧气有了一定的了解: