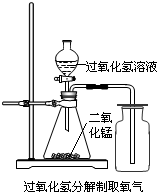
(2004?北碚区)实验室中,常采用分解过氧化氢溶液(二氧化锰作催化剂)或加热高锰酸钾的方法制取氧气.
(1)写出用上述两种方法分别制取氧气的化学反应方程式:
、
.
(2)用过氧化氢分解制取氧气的装置如图所示:
图中收集氧气的方法叫做
向上排空气法
向上排空气法
.可用此方法收集氧气的原因是
O2的密度比空气密度略大
O2的密度比空气密度略大
(3)用该方法收集氧气时,检验集气瓶中氧气是否集满的方法是
C
C
.
A.把点燃的木条伸入瓶内
B.把带火星的木条伸人瓶内
C.把带火星的木条放在瓶口
(4)如果锥形瓶中的反应很剧烈,应该采取的安全措施是
①
①
(填编号).
①减慢液体滴加的速度 ②换用体积较小的锥形瓶 ③加热锥形瓶
(5)请计算,制取3.2g氧气,理论上需高锰酸钾的质量为
31.6
31.6
g;需质量分数为30%过氧化氢溶液的质量为
22.7
22.7
g.
(6)某化学试剂公司报价:高锰酸钾30.50元/kg,30%过氧化氢溶液21.70元/kg.请从实验操作和生产成本两方面考虑,用
分解过氧化氢
分解过氧化氢
方法制取氧气更好(二氧化锰价格低、耗量少,忽略不计).这种方法的主要优点是
①实验室用H2O2制取02不需加热,②制取相同质量(3.2g)O2时购买H2O2(约0.49元)比KMnO4(约0.96元)价格低
①实验室用H2O2制取02不需加热,②制取相同质量(3.2g)O2时购买H2O2(约0.49元)比KMnO4(约0.96元)价格低
.

 淡水资源紧缺的原因之一是人类的生产、生活造成了水的污染.某城镇生产、生活区的分布如下图所示.河流中A、B、C三处某次水样抽测结果如表所示.
淡水资源紧缺的原因之一是人类的生产、生活造成了水的污染.某城镇生产、生活区的分布如下图所示.河流中A、B、C三处某次水样抽测结果如表所示. (2004?北碚区)实验室中,常采用分解过氧化氢溶液(二氧化锰作催化剂)或加热高锰酸钾的方法制取氧气.
(2004?北碚区)实验室中,常采用分解过氧化氢溶液(二氧化锰作催化剂)或加热高锰酸钾的方法制取氧气.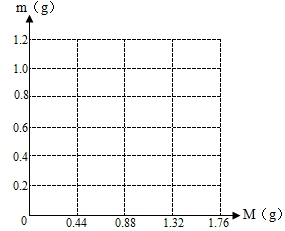 将KCl和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的0.44g.
将KCl和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的0.44g.