已知木炭粉和Fe
2O
3 反应的化学方程式为:2Fe
2O
3+3C
4Fe+3CO
2↑或者为:Fe
2O
3+3C
2Fe+3CO↑
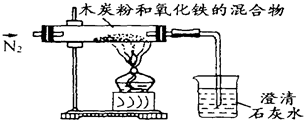
某同学设计一个实验,假定恰好完全反应,测定此反应中的气体生成物,实验装置如图.
(1)实验中通入的气体是纯净干燥的N
2,写出不用空气的主要理由
空气中的氧气、二氧化碳会与木炭反应产生一氧化碳和二氧化碳,将使测定的结果不准确
空气中的氧气、二氧化碳会与木炭反应产生一氧化碳和二氧化碳,将使测定的结果不准确
,实验也不能用潮湿的氮气,原因是
潮湿的氮气中含有水分,水会与木炭反应产生一氧化碳,也将使得测定的结果不准确
潮湿的氮气中含有水分,水会与木炭反应产生一氧化碳,也将使得测定的结果不准确
.
(2)如用氧化铁与木炭粉的混合物3.8g反应,充分反应后测得固体质量减轻1.56g,则生成的气体为
CO和CO2的混合气体
CO和CO2的混合气体
.
(3)烧杯内适量澄清石灰水的现象为
澄清石灰水变浑浊
澄清石灰水变浑浊
,若氧化铁的质量与本次实验相同,要使澄清石灰水的现象也与本次实验相同,则固体混合物总质量(m)的取值范围应该是
大于3.63g而小于4.2g
大于3.63g而小于4.2g
.
(4)合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe
2O
3.
①当催化剂中FeO与Fe
2O
3的质量之比为9:20时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为
72%
72%
.
②以Fe
2O
3为原料制备上述催化剂,可向其中加入适量碳,发生如下反应:2Fe
2O
3+C
4FeO十CO
2↑,为制得这种活性最高的催化剂,应向480g Fe
2O
3粉末中加入碳多少克?
6g
6g
.

 已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3+3C
已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3+3C 已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3+3C
已知木炭粉和Fe2O3 反应的化学方程式为:2Fe2O3+3C 4Fe+3CO2↑或者为:Fe2O3+3C
4Fe+3CO2↑或者为:Fe2O3+3C 2Fe+3CO↑
2Fe+3CO↑ 4FeO十CO2↑,为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入碳多少克?______.
4FeO十CO2↑,为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入碳多少克?______.