
题目列表(包括答案和解析)
| A、反应①和③都属于复分解反应 | B、三个反应中硫元素的化合价都没有改变 | C、可循环使用的物质是Na2SO3 | D、反应①说明SO2与CO2有相似的化学性质 |
Ⅰ.在高温条件下,A、B两种物质可以发生化学反应生成C和D。反应前后分子种类变化的微观示意图如下所示。
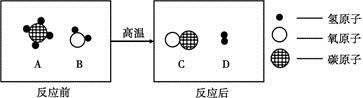
(1)一个A分子中共含有 个原子。
(2)四种物质中,属于单质的是 (填上图中的字母,下同),可用作燃料的是 。
(3)B中氢元素与氧元素的质量比为_____________;A中氢元素的质量分数为________。
(4)该反应中化学方程式为__________________________________。
Ⅱ.(6分)在煤中加入适量的生石灰(CaO)制成供居民取暖的“环保煤”,以减少二氧化硫的排放,减弱SO2对空气的污染。燃烧时生石灰吸收二氧化硫的化学方程式如下:
2CaO + 2SO2 +O2高温 2CaSO4
试回答下列问题:
①煤燃烧会排放烟尘、二氧化碳、二氧化硫、一氧化碳气体,这些物质中会引起温室效应的是 ;造成酸雨的是 。
②若煤厂一次共加入生石灰168t,则理论上最多可吸收二氧化硫的质量是多少?

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com