
题目列表(包括答案和解析)
(10分)下表是某城市某日的空气质量报告:
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
(10分)下表是某城市某日的空气质量报告:
|
污染指数 |
首要污染物 |
空气质量级别 |
空气质量状况 |
|
55 |
SO2 |
II |
良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
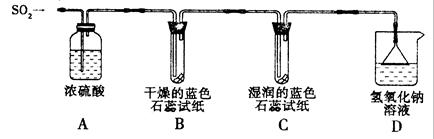
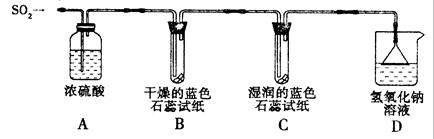
[探究实验一]用下图所示装置进行实验。
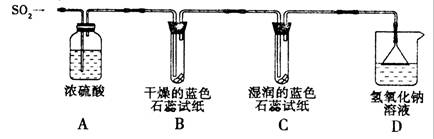
① A装置的作用是 (填“干燥”或“氧化”)SO2气体。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸。
③ D装置的作用是 ,D中发生反应的化学方程式是 。
[探究实验二]往盛有水的烧杯中通入SO2气体,测得所得溶液的pH 7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐 (填“变大”或“变小”),直至恒定。说明烧杯中的溶液被空气中的氧气氧化最终生成H2SO4。
[查阅资料]SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。则在此过程中的飘尘是作为 (填“催化剂”或“氧化剂”)。
[探究结论]SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
[知识拓展]
(1)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因。
(2)该市某工厂的燃料煤中硫的质量分数为0.16%,该工厂每天燃烧这种煤100吨。如果煤中的硫全部转化为SO2,那么这些SO2在标准状况下的体积约为 m3。
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
(10分)酸雨是指pH<5.6的雨、雪等各种形式的大气降水。二氧化硫是形成酸雨的主要因素之一,它主要是由含硫燃料(煤和石油)燃烧和金属冶炼厂释放的二氧化硫气体造成。酸雨的危害极大,减少二氧化硫等污染物的排放,保护环境是非常重要的。某校化学兴趣小组的学生,分成两组对酸雨及空气中二氧化硫的含量进行了测定。
第一组,取刚降到地面的酸雨水样,进行了如下实验:
(1)将一片红色的玫瑰花瓣浸在一份水样中
(2)向雨水试样中滴加氯化钡溶液,有白色浑浊出现
(3)每隔一定时间测定其pH,数据如表Ⅰ所示。
表Ⅰ 不同时间酸雨的pH
| 测定时间/小时钟 | 0 | 1 | 2 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
(1)一段时间后,观察到红色变浅,可能的原因是 ▲
(2)生成白色浑浊的离子方程式 ▲
(3)分析上述pH数据变化,你认为可能的原因是(用化学方程式表示) ▲
(4)如果取该雨水和蒸馏水混合,再测pH,结果将 ▲ (填“变大”“变小”或“不变”)
第二组,用拟用下列装置定量分析空气中SO2的含量:

(5)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的离子方程式
5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。
该反应的现象是 ▲ ,SO2在该反应中显 ▲ (填“氧化”或“还原”)性。发生了 ▲ 反应(填“氧化”或“还原”)
(6)通入空气前应进行的实验操作是 ▲ ;KMnO4溶液中导管末端做成球状多孔结构的作用是 ▲
(7)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为 ▲ g/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com