实验室可用KClO
3和MnO
2的固体混合物加热制取氧气.现取30.5g的固体混合物加热一段时间收集到一定质量的氧气后,停止反应.
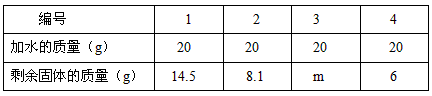
(1)欲求得氧气的质量,将试管中的剩余物冷却到室温后,通过向该试管分多次加水测定剩余物质的办法求得.加水的质量与剩余固体的质量见下表:(MnO
2不溶于水)
| 编号 |
1 |
2 |
3 |
4 |
| 加水的质量(g) |
20 |
20 |
20 |
20 |
| 剩余固体的质量(g) |
14.5 |
8.1 |
m |
6 |
表中m的值为______,所得氧气的质量为______.
(2)为了测定固体混合物中MnO
2的质量分数,需用______方法回收MnO
2.
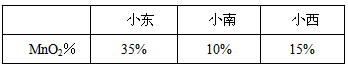
实验结束后,有3位同学分别展示了所测MnO
2的质量分数.
| |
小东 |
小南 |
小西 |
| MnO2% |
35% |
10% |
15% |
老师的评价是:小东结果偏高,小南、小西结果偏低.于是全班同学讨论误差,下列所找原因正确的是(填序号)______.
①小东:称量KClO
3和MnO
2固体混合物时将固体放在天平的右边(1g以下用砝码)
②小东:滤液浑浊就干燥
③小东:烧杯里的物质还未充分溶解就开始过滤
④小南:称余下固体时只在天平的左盘垫了张纸
⑤小西:称余下固体前,部分固体洒落地下
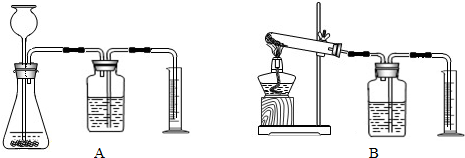
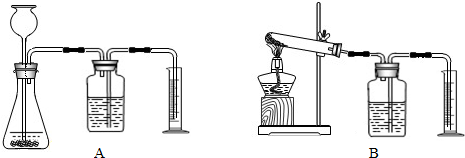
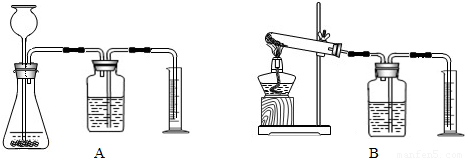
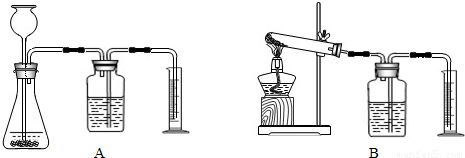
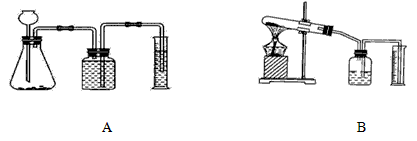
(3)若要证明MnO
2是该反应的催化剂,还需补做两个实验:①证明MnO
2在反应前后化学性质不变.
②证明MnO
2能改变KClO
3反应放出氧气的速率.完成②需选用下图装置中的(填序号)______.要比较产生O
2的快慢,除可以直接观察气泡产生的快慢,还可以______.