
题目列表(包括答案和解析)
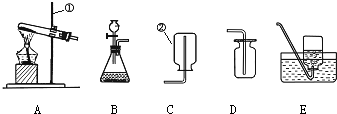
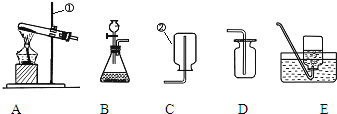
请根据下列装置,回答问题:

 |
(1)写出标号①和②的仪器名称 。
(2)装置B中仪器①的下端管口要浸在液面下,是为了 。
(3)实验室加热暗紫色固体制取O2的反应符号表达式为 ,若用排水法收集气体,当观察到_____ ___时才开始收集;停止实验时,应该_____ _____ _,否则_______________ ____________。
(4)若用装置C、D或K收集O2,要使收集O2干燥且纯净,则应选 装置。若用排水法收集到的O2不纯,可能的原因是?(两条)_____________ ____________、_________________ ___________。
若用向上排空气法收集氧气,如何验满?_________ ____________ _________。
实验过程中发现水槽中的水变成了浅紫红色,可能的操作原因:_____ ___________ 。
(5)用过氧化氢溶液与二氧化锰制取O2,装置G虽然操作简便,但要得到平稳的气流,从H、I、J中选取 取代G中的单孔塞,以达到目的。若选用H与锥形瓶组装的发生装置,当反应停止时,集气瓶中还差少量O2,为集满O2,在不拆卸装置的前提下,可以 、
。实验结束后,该同学发现收集到的气体比预计的少很多,百思不得其解。你认为可能的原因是:___________ ___ _________。
(6)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过以下四步实验操作可回收二氧化锰。正确操作的先后顺序是 (填写选项序号)。
a.烘干 b.溶解 c.过滤 d.洗涤
(7)实验室利用F装置制备氢气,事先将锌粒放于有孔隔板之上,然后从另一端加入稀盐酸,装置F相对于装置B制备氢气,具有的优点是 。若用L装置收集氢气,则气体从 端通入(填“a”或“b”,下同);若要将L装置中的氢气用水排出,则水从 端通入。
 (8)查阅资料:实验室常用加热氯化铵(NH4Cl)和熟石灰[Ca(OH)2]两种固体混合物
(8)查阅资料:实验室常用加热氯化铵(NH4Cl)和熟石灰[Ca(OH)2]两种固体混合物
的方法制取氨气(NH3),同时还生成氯化钙(CaCl2)和水,则该反应的符号表达式为
;另外,氨气有刺激性气味且极易溶于水,则在
实验室里氨气的制取装置是_________。小军设计了如图所示的一个实验:充满氨气的
一支试管倒置于一个装有足量水的烧杯中。一段时间后,将会看到: 。
(9)某化学小组在学习了制取O2后,他们发现在实验室里用5% H2O2溶液加热制O2,用带火星的木条检验,木条很难复燃。同学们经过认真观察,猜想其可能原因是 。
为了验证此猜想是否正确,兴趣小组的同学经过热烈讨论,制定了实验方案并进行了实验。
第一组同学采取增大H2O2溶液浓度的方法,用10%的H2O2溶液加热,
 一段时间后,用带火星的木条检验,木条复燃;
一段时间后,用带火星的木条检验,木条复燃;
第二组同学在5%的H2O2溶液中加入2滴新制氢氧化钠溶液,加热
一段时间后,用带火星木条检验,木条复燃;
第三组同学从实验装置上进行了改进,效果很好(见图)。
在实验基础上,同学们经过交流讨论,得出了一些结论:
①由第一组实验可得出影响H2O2分解产生O2多少及快慢的因素之一是 ;
②由第二组实验可分析得出氢氧化钠所起的作用可能是 ;
③第三组实验验证了实验前同学们猜想的正确性。其中浓硫酸的作用是 ;
④小李同学认真观察了第三组同学的实验装置,提出了一种简单的改进装置,经现场实验,效果很好,请你说出他改进的地方: 。

| ||
| ||
| 二氧化锰 |
| 加热 |
| 二氧化锰 |
| 加热 |
| 二氧化锰 |
| 二氧化锰 |
| 二氧化锰 |
| 加热 |
| 二氧化锰 |
| 加热 |
| 二氧化锰 |
| 二氧化锰 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com