
题目列表(包括答案和解析)
常温下,将20.0 g 14.0%的NaCl溶液跟30.0 g 24.0%的NaCl溶液混合,得到密度为1.15 g·ml-1的混合溶液,计算该混合溶液的质量分数为________,物质的量浓度为________mol·L-1.在100 g水中需溶入________mol NaCl,才能使其浓度与上述混合溶液的浓度相等.
常温下,将20.0 g 14.0%的NaCl溶液跟30.0 g 24.0%的NaCl溶液混合,得到密度为1.15 g·ml-1的混合溶液,计算该混合溶液的质量分数为________,物质的量浓度为________mol·L-1.在100 g水中需溶入________mol NaCl,才能使其浓度与上述混合溶液的浓度相等.
(1)该混合溶液的质量分数;
(2)该溶液的物质的量浓度;
(3)在1 000 g水中需溶入多少摩尔NaCl,才能使其浓度恰好与上述混合溶液的浓度相等。
常温下将20.0 g 14%的NaCl溶液跟30 g 24%的NaCl 溶液混合,得到密度为1.15 g/mL的混合溶液,计算:
①该混合溶液的质量分数.
②该混合溶液的物质的量浓度.
③1000 g水中需加多少物质的量的NaCl,才能使浓度恰好与上述混合液的浓度相等?
(1) 实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30—35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。
![]() 四种盐在不同温度下的溶解度(g / 100 g水)表
四种盐在不同温度下的溶解度(g / 100 g水)表
|
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
请回答: ![]()
![]()
![]()
![]()
![]() ①反应控制在30—35℃,是因为高于35℃NH4HCO3会分解,低于30℃则反应速率降低 ,为控制此温度范围,通常采取的加热方法为 ;
①反应控制在30—35℃,是因为高于35℃NH4HCO3会分解,低于30℃则反应速率降低 ,为控制此温度范围,通常采取的加热方法为 ;
![]() ②加料完毕,保温30分钟,目的________________________ ;
②加料完毕,保温30分钟,目的________________________ ;
![]() ③静置后只析出NaHCO3晶体的原因__________________________ ;
③静置后只析出NaHCO3晶体的原因__________________________ ;
![]() ④过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使 _________(填化学式)循环使用,回收得到NH4Cl晶体。
④过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使 _________(填化学式)循环使用,回收得到NH4Cl晶体。
![]() (2)我国科学家侯德榜改革国外的纯碱生产工艺,使其更加先进,被称为侯德榜制碱法,生产流程为:
(2)我国科学家侯德榜改革国外的纯碱生产工艺,使其更加先进,被称为侯德榜制碱法,生产流程为:
![]()
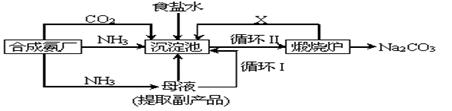
![]() ⑤沉淀池中反应的化学方程式: _______-_______ __ ;
⑤沉淀池中反应的化学方程式: _______-_______ __ ;
![]() ⑥检验产品碳酸钠中是否含有氯化钠的操作方法为: 。
⑥检验产品碳酸钠中是否含有氯化钠的操作方法为: 。
![]() ⑦循环(I)中应该加入或通入物质的化学式为 。
⑦循环(I)中应该加入或通入物质的化学式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com