29、小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度.于是他对所得溶液的酸碱性进行探究.
【探究目的】探究所得溶液的酸碱性
【提出猜想】所得溶液可能呈碱性,也可能呈
中
性,还可能呈
酸
性.
【实验验证】

【分析与思考】
1溶液呈碱性,则溶液中使其呈碱性的离子是
OH-
(填写微粒符号),为避免碱性溶液污染环境,小亮对所得溶液进行了如下处理:向溶液中逐滴加入
CuCl2
溶液,直到不再产生沉淀为止.然后过滤,把滤液倒入蒸发皿中加热,得到氯化钠晶体,该过程涉及的化学方程式为
CuCl2+2NaOH═Cu(OH)2↓+2NaCl
.
(2)若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到
有气泡产生
,则所取溶液呈酸性;若无明显现象,则呈中性.
方案二:取样,加入
锌粒
,若观察到
Zn+2HCl═ZnCl2+H2↑
,则所取溶液呈酸性,该若无明显现象,则呈中性.

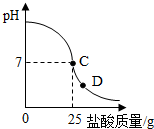 出加入盐酸的质量与烧杯中溶液pH的关系如图.
出加入盐酸的质量与烧杯中溶液pH的关系如图.