
题目列表(包括答案和解析)
|
在反应SiO2+3C | |
A. |
36∶60 |
B. |
60∶36 |
C. |
1∶2 |
D. |
1∶3 |
(08山东省平度一中测试)在反应SiO2+3C SiC+2CO中,氧化剂和还原剂物质的量之比是 ( )
A.1:3 B.3:1 C.1:2 D.3:1
在反应SiO2+3C![]() Sic+2CO中,氧化剂和还原剂物质的量之比是 ( )
Sic+2CO中,氧化剂和还原剂物质的量之比是 ( )
A.1:3 B.3:1 C.1:2 D.2:1
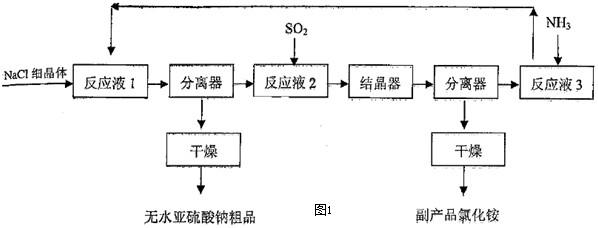
| 原料 | 理论值 | 实际值 | 利用率 |
| SO2 | 50.79 | 54.4 | 93.36% |
| NaCl | 92.86 | 101.0 | 91.94% |
| NH3 | 26.98 | 30.5 | 88.46% |
| 副产品NH4Cl | a | 87.1 | -------- |
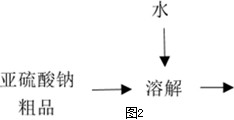
二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料[ 已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1) △H=-1455kJ/mol ]。同时它也可以作为制冷剂而替代氟氯代烃。工业上制备二甲醚的主要方法经历了三个阶段:
①甲醇液体在浓硫酸作用下或甲醇气体在催化作用下直接脱水制二甲醚;2CH3OH CH3OCH3+H2O
CH3OCH3+H2O
②合成气CO与H2直接合成二甲醚:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) △H=-247kJ/mol
CH3OCH3(g)+CO2(g) △H=-247kJ/mol
③天然气与水蒸气反应制备二甲醚。以CH4和H2O为原料制备二甲醚和甲醇工业流程如下:

(1)写出CO(g)、H2(g)、O2(g)反应生成CO2(g)和H2O(1)的热化学方程式(结果保留一位小数) 。
(2)①方法中用甲醇液体与浓硫酸作用直接脱水制二甲醚,尽管产率高,但是逐步被淘汰的主要原因是 。
(3)在反应室2中,一定条件下发生反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是 。
CH3OCH3(g)+CO2(g)在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是 。
A.低温高压 B.加催化剂 C.增加CO浓度 D.分离出二甲醚
(4)在反应室3中,在一定温度和压强条件下发生了反应:3H2(g)+CO2(g)  CH3OH(g)+H2O (g) △H<0反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是
(填序号)。
CH3OH(g)+H2O (g) △H<0反应达到平衡时,改变温度(T)和压强(P),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(P)的关系判断正确的是
(填序号)。

A.P3>P2 T3>T2 B.P2>P4 T4>T2
C.P1>P3 T1>T3 D.P1>P4 T2>T3
(5)反应室1中发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)
△H>0写出平衡常数的表达式:
。如果温度降低,该反应的平衡常数
。(填“不变”、“变大”、“变小”)
CO(g)+3H2(g)
△H>0写出平衡常数的表达式:
。如果温度降低,该反应的平衡常数
。(填“不变”、“变大”、“变小”)
(6)如图为绿色电源“二甲醚燃料电池”的工作原理示意图。则a电极的反应式为:________________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com