
题目列表(包括答案和解析)
元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题: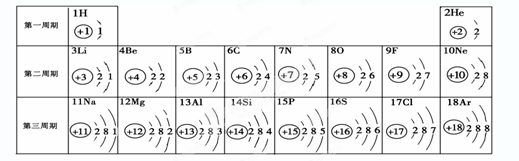
(1)请从上表中查出关于硼元素的一条信息____________。
(2)第3周期(横行)中属于金属元素的是 (填一种),其阳离子是 (填离子符号)
(3)第11号元素与第17号元素组成的物质是 ,构成该物质的微粒是 (选填“分子”、“原子”或“离子”)。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是 (填标号)。
a.He和Ne b.B和Mg c.Al和Si d.F和Cl
(5)上述元素在周期表中处于同一周期的原因是_______。
(6)研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小。我分析第三周期从11~17号元素原子半径变化规律是 _________________________________。
(7)第6号碳元素和氢元素形成的物质乙炔在空气中燃烧放出大量热,生成二氧化碳和水,写出该反应的文字表达式
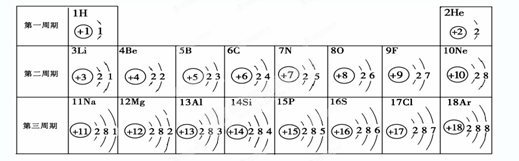
元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:

(1)请从上表中查出关于硼元素的一条信息____________。
(2)第3周期(横行)中属于金属元素的是 (填一种),其阳离子是 (填离子符号)
(3)第11号元素与第17号元素组成的物质是 ,构成该物质的微粒是 (选填“分子”、“原子”或“离子”)。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是 (填标号)。
a.He和Ne b.B和Mg c.Al和Si d.F和Cl
(5)上述元素在周期表中处于同一周期的原因是_______。
(6)研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小。我分析第三周期从11~17号元素原子半径变化规律是 _________________________________。
(7)第6号碳元素和氢元素形成的物质乙炔在空气中燃烧放出大量热,生成二氧化碳和水,写出该反应的文字表达式
元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
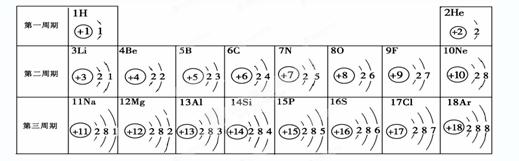
(1)请从上表中查 出关于硼元素的一条信息____________。
出关于硼元素的一条信息____________。
(2)第3周期(横行)中属于金属元素的是 (填一种),其阳离子是 (填离子符号)
(3)第11号元素与第17号元素组成的物质是 ,构成该物质的微粒是 (选填“分子”、“原子”或“离子”)。
(4) 在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是 (填标号)。
在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是 (填标号)。
a. He和Ne b. B和Mg c. Al和Si d. F和Cl
(5)上述元素在周期表中处于同一周期的原因是_______。
(6)研究表明:第二周期从3~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小。我分析第三周期从11~17号元素原子半径变化规律是 _________________________________。
(7) 第6号碳元素和氢元素形成的物质乙炔在空气中燃烧放出大量热,生成二氧化碳和水,写出该反应的文字表达式 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com