
题目列表(包括答案和解析)
|
下列叙述正确的是 | |
| [ ] | |
A. |
标准状况下的气体摩尔体积约为22.4 L |
B. |
H2的摩尔质量为2 g/mol |
C. |
摩尔是用来衡量微观粒子多少的一种物理量 |
D. |
0.1 mol H2SO4含有氢原子数的准确值为1.204×1023 |
 A、B、C、D、E五种短周期元素,原子序数依次递增.A原子形成的阳离子是一个质子,B原子的最外层电子数是次外层的2倍,C原子的最外层电子数与B原子的核外电子总数相等,D在同周期元素中原子半径最大,E与C是同主族元素.C、D两种元素可形成化合物甲,甲中既有离子键又有共价键;A、B、C、D四种元素可形成化合物乙,乙放入水中所得溶液显碱性.请回答:
A、B、C、D、E五种短周期元素,原子序数依次递增.A原子形成的阳离子是一个质子,B原子的最外层电子数是次外层的2倍,C原子的最外层电子数与B原子的核外电子总数相等,D在同周期元素中原子半径最大,E与C是同主族元素.C、D两种元素可形成化合物甲,甲中既有离子键又有共价键;A、B、C、D四种元素可形成化合物乙,乙放入水中所得溶液显碱性.请回答: ]2-Na+
]2-Na+ ]2-Na+
]2-Na+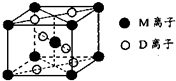 (2013?绵阳模拟)A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大.其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的 简单离子在同周期元素的简单离子中半径最小,D、G同主族;B与D形成的化合物有多种,其中一种是红棕色气体.
(2013?绵阳模拟)A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大.其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的 简单离子在同周期元素的简单离子中半径最小,D、G同主族;B与D形成的化合物有多种,其中一种是红棕色气体.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com