
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||||||||||||||
|
在2 L的密闭容器中装有0.4 mol X和0.2 mol Y,在一定条件下发生反应: 2X(g)+Y(g)=2Z(g) 2 s末测得容器中有0.36 mol Z.下列有关说法中错误的是 | |
| [ ] | |
A. |
2 min末X的浓度0.02 mol/L |
B. |
2 s内生成Z的速率为0.09 mol/(L.s) |
C. |
反应一定达到限度 |
D. |
2 s末Y的转化率为90% |
某可逆反应的平衡常数表达式为K=![]() ,恒容时,温度升高H2浓度减小.试回答下列问题:
,恒容时,温度升高H2浓度减小.试回答下列问题:
(1)该反应的化学方程式为:________.
(2)温度升高,该反应的K值________(填“增大”“减小”或“不变”),化学平衡移动达到新的平衡后,CO2和CO体积比________(填“增大”“减小”或“不变”).
(3)在一体积为10 L的容器中,通人一定量的CO和H2O,在850℃时发生反应,CO和H2O浓度变化如下图.则0-4 min的平均反应速率v(CO)=________mol/(L·min),850℃的化学平衡常数的值K=________.
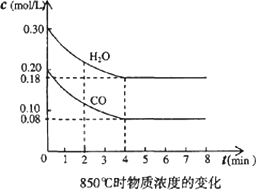
(4)850℃时,在相同容器中发生反应CO2+H2![]() CO+H2O(g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气0.08 mol/L,此时v(正)________v(逆)(“大于”“小于”或“等于”)
CO+H2O(g),t时刻容器内各物质的浓度分别为:一氧化碳0.09 mol/L、水蒸气0.09 mol/L、二氧化碳0.08 mol/L、氢气0.08 mol/L,此时v(正)________v(逆)(“大于”“小于”或“等于”)
将4 mol SO3气和4 mol NO置于2 L容器中,一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):?
2SO3(g)(1)当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1 mol、n(NO2)=3.6 mol,则此时SO3气的物质的量为________.
(2)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和________,或NO和________(填它们的分子式).
(3)若在另外一个2 L的容器中只发生反应2NO+O2![]() 2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,各物质的浓度可能是(填字母代号)________.
2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,各物质的浓度可能是(填字母代号)________.
A.c(NO)=0.35 mol/L或c(NO)=0.09 mol/L
B.c(NO2)=0.4 mol/L
C.c(NO2)=0.35 mol/L
D.c(O2)=0.2 mol/L或c(NO)=0.4 mol/L
(1) (4分)在带有活塞的密闭容器中发生反应:Fe2O3+3H2===2Fe+3H2O,采取下列措施不能改变反应速率的是( )
A.增大Fe2O3的投入量
B.保持容器的体积不变,增加H2的输入量
C.充入N2,保持容器内压强不变
D.充入N2,保持容器体积不变
(8分)往容积为10 L的密闭容器内通入40 mol N2和120 mol H2,在一定条件下进行反应,经2 s后达到平衡状态,平衡时c(N2)为2 mol/L。
(2)用H2的浓度变化表示2 s内的平均速率v(H2)=________。
(3)氮气的转化率是________。
(4)平衡时混合气体中氨的体积分数是________。
(5)容器内反应前后压强比是________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com