
题目列表(包括答案和解析)
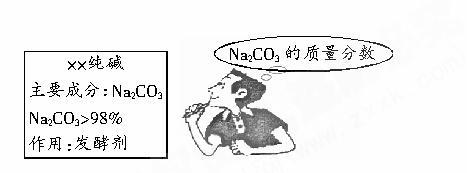
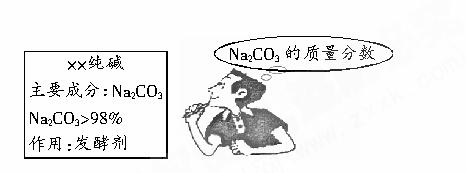
 小强的妈妈要焙制面包,叫小强去商店买一包纯碱,小强仔细看了包装说明(如图),并产生疑问:这包纯碱中Na2CO3的质量分数是否如说明所标注的一样,不小于98%呢?回到学校,小强取出从家里带来的一小包纯碱样品进行实验:准确称取5.5g样品放入烧杯中,向其中滴加盐酸至刚好完全反应(忽略CO2溶于水),共用去稀盐酸25g,得到溶液质量为28.3g(注:杂质溶于水,且与盐酸不反应.碳酸钠与盐酸反应的化学方程式为:
小强的妈妈要焙制面包,叫小强去商店买一包纯碱,小强仔细看了包装说明(如图),并产生疑问:这包纯碱中Na2CO3的质量分数是否如说明所标注的一样,不小于98%呢?回到学校,小强取出从家里带来的一小包纯碱样品进行实验:准确称取5.5g样品放入烧杯中,向其中滴加盐酸至刚好完全反应(忽略CO2溶于水),共用去稀盐酸25g,得到溶液质量为28.3g(注:杂质溶于水,且与盐酸不反应.碳酸钠与盐酸反应的化学方程式为:
小强的妈妈要焙制面包,叫小强去商店买回一包纯碱,小强仔细看了包装说明(如下图),并产生疑问。回到学校,他取出从家里带来的一小包纯碱样品进行实验:准确称取5.5 g样品放入烧杯中,在滴加盐酸至刚好完全反应时,共用去稀盐酸25 g,所得溶液质量为28.3 g(杂质溶于水但与盐酸不反应)。求:
(1)生成CO2的质量为____________。
(2)通过计算判断纯碱样品中碳酸钠的质量分数是否与包装说明相符。
小强的妈妈要焙制面包,叫小强去商店买回一包纯碱,小强仔细看了包装说明(如下图),并产生疑问。回到学校,他取出从家里带来的一小包纯碱样品进行实验:准确称取5.5 g样品放入烧杯中,在滴加盐酸至刚好完全反应时,共用去稀盐酸25 g,所得溶液质量为28.3 g(杂质溶于水但与盐酸不反应)。求:
(1)生成CO2的质量为____________。
(2)通过计算判断纯碱样品中碳酸钠的质量分数是否与包装说明相符。
小强的妈妈要焙制面包,叫小强去商店买回一包纯碱,小强仔细看了包装说明(如下图),并产生疑问。回到学校,他取出从家里带来的一小包纯碱样品进行实验:准确称取5.5 g样品放入烧杯中,在滴加盐酸至刚好完全反应时,共用去稀盐酸25 g,所得溶液质量为28.3 g(杂质溶于水但与盐酸不反应)。求:

(1)生成CO2的质量为____________。
(2)通过计算判断纯碱样品中碳酸钠的质量分数是否与包装说明相符。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com