
题目列表(包括答案和解析)
|
下列说法中正确的是 | |
| [ ] | |
A. |
在25℃纯水中,c(H+)=c(OH-)=10-7 mol·L-1,呈中性 |
B. |
溶液中若c(OH-)>10-7 mol·L-1,则c(H+)>c(OH-),溶液显酸性 |
C. |
c(H+)越大,则pH越大,溶液的碱性越强 |
D. |
pH为0的溶液,其中只有H+而无OH- |
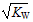
(Ⅰ)(6分)现有下列物质: ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)在上述状态下能导电的物质是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质,但溶于水后的水溶液能导电的是 ;
(Ⅱ)(4分)
某化学实验小组探究市售食用白醋中醋酸的的准确浓度,取25.00mL某品牌食用白
醋于锥形瓶中,在实验室用浓度为cb mol/L的标准NaOH溶液对其进行滴定。
(1)左图表示50mL滴定管中液面的位置,若A与C刻度间相差l mL,
A处的刻度为25,滴定管中液面读数应为 mL。
(2)为了减小实验误差,该同学一共进行了三次实验,假设每次
所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实
验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
 H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5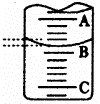
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
 H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH  H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入0.1 mol·L-1的 HA、HCl溶液各10 mL,按图装好,观察现象;
乙:① 用pH计测定物质的量浓度均为0.1mol·L-1 HA和HCl溶液的pH;
② 再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴约为1/25 mL)分别稀释至100 mL,再用pH计测其pH变化
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的pH 1(填“>”、“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是:
A.加入HCl溶液后,试管上方的气球鼓起快
B.加入HA溶液后, 试管上方的气球鼓起慢
C.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
(2)乙同学设计的实验第______步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:①使HA的电离程度和c(H+)都减小, c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入_________试剂(选填“A”“B”“C”“D”,下同);②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入_____试剂。
A. NaA固体(可完全溶于水)
B.1 mol·L-1 NaOH溶液
C. 1 mol·L-1 H2SO4 D.2 mol·L-1 HA
(3)pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积V的关系如图所示,则下列说法不正确的有
A.两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
E.稀释后A溶液中水的电离程度比B溶液中水的电离程度小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com