
题目列表(包括答案和解析)
反应条件 | 条件改变 | v(正) | v(逆) | v(正)与v(逆)的关系 | 平衡移动方向 | |
浓度 | 1.增大c(反)浓度 |
|
|
|
| |
2.减小c(反)浓度 |
|
|
|
| ||
3.增大c(生)浓度 |
|
|
|
| ||
4.减小c(生)浓度 |
|
|
|
| ||
压强 | 加压 | 5.m+n>p+q |
|
|
|
|
6.m+n<p+q |
|
|
|
| ||
7.m+n=p+q |
|
|
|
| ||
减压 | 8.m+n>p+q |
|
|
|
| |
9.m+n<p+q |
|
|
|
| ||
10.m+n=p+q |
|
|
|
| ||
温度 | 11.升温 |
|
|
|
| |
12.降温 |
|
|
|
| ||
催化剂 | 13.加入催化剂 |
|
|
|
| |
对于可逆反应,mA(g)+nB (g)  pC(g)+qD (g);H <0有下列判断,其中正确的是
pC(g)+qD (g);H <0有下列判断,其中正确的是
A.若温度不变,将容器的体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<q+p
B.若平衡时,A、B的转化率相等,说明反应开始时A、B的物质的量之比为m:n
C.若平衡体系共有气体amol,再向其中加入bmolB,当重新达到平衡时,气体的总物质的量等于(a+b)mol,则m+n>p+q
D.加催化剂或增大压强,都能实现如图中a→b的变化

对于可逆反应,mA(g)+nB (g) ![]() pC(g)+qD (g);H <0有下列判断,其中正确的是
pC(g)+qD (g);H <0有下列判断,其中正确的是
A.若温度不变,将容器的体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<q+p
B.若平衡时,A、B的转化率相等,说明反应开始时A、B的物质的量之比为m:n
C.若平衡体系共有气体amol,再向其中加入bmolB,当重新达到平衡时,气体的总物质的量等于(a+b)mol,则m+n>p+q
D.加催化剂或增大压强,都能实现如图中a→b的变化
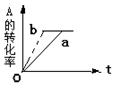
对于可逆反应,mA(g)+nB (g) pC(g)+qD (g);H <0有下列判断,其中正确的是
A.若温度不变,将容器的体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<q+p
B.若平衡时,A、B的转化率相等,说明反应开始时A、B的物质的量之比为m:n
C.若平衡体系共有气体amol,再向其中加入bmolB,当重新达到平衡时,气体的总物质的量等于(a+b)mol,则m+n>p+q
D.加催化剂或增大压强,都能实现如图中a→b的变化
对于可逆反应,mA(g)+nB (g) pC(g)+qD (g);H <0有下列判断,其中正确的是
pC(g)+qD (g);H <0有下列判断,其中正确的是
A.若温度不变,将容器的 体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<q+p
体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<q+p
B.若平衡时,A、B的转化率相等,说明反应开始时A、B的物质的量之比为m:n
C.若平衡体系共有气体amol,再向其中加入bmolB,当重新达到平衡时,气体的总物质的量等于(a+b)mol,则m+n>p+q
D.加催化剂或增大压强,都能实现如图中a→b的变 化
化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com