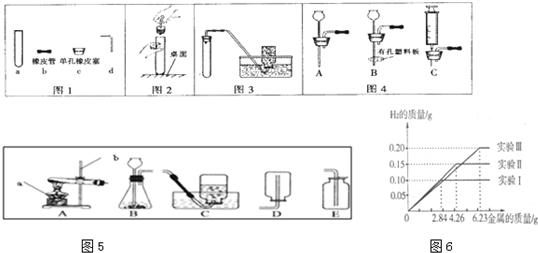
夏天到了,衣服上常会留下难以清洗的汗渍、果汁渍等.现在市场上出售一种“污渍爆炸盐”,宣称“含天然活性氧,能在瞬间去除洗衣粉难以除去的多种顽固污渍”.小强同学对这种“污渍爆炸盐”的化学成分非常感兴趣,对其化学成分进行探究.

查阅相关资料:“污渍爆炸盐”主要有效成份为过碳酸钠,化学式为2Na
2CO
3?3H
2O
2,俗称固体双氧水,白色结晶颗粒.过碳酸钠溶于水时,分解生成碳酸钠和过氧化氢,目前已成为世界上广泛应用的主要洗涤助剂之一.
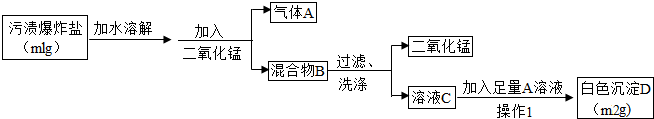
探究一:确证污渍爆炸盐的化学成分及其化学式
小强同学的实验设计如下所示.请你运用初中所学知识,帮助小强同学完成下列探究.
(1)小强同学把带火星的木条伸入气体A中,带火星的木条复燃,则气体A为
,说明“污渍爆炸盐”溶于水生成过氧化氢;
(2)小强从氢氧化钙溶液和氢氧化钡溶液这两种溶液中选择氢氧化钡溶液作为加入的A溶液,则小强选择的理由为
;
实验过程中观察到
,说明“污渍爆炸盐”溶于水生成碳酸钠;
(3)操作Ⅰ为
、洗涤、干燥,检验沉淀是否洗涤干净的方法是
;
实验的初步结论
小强认为:“污渍爆炸盐”溶于水生成碳酸钠和过氧化氢,“污渍爆炸盐”的主要化学成分是过碳酸钠.
(4)若m1=31.4,m2=39.4,请根据数据计算确证污渍爆炸盐的化学式为2Na
2CO
3?3H
2O
2.
计算过程:解:
探究二:变质污渍爆炸盐的纯度测定
已知:过碳酸钠与硫酸溶液反应的化学方程式如下:
2Na
2CO
3?3H
2O
2+2H
2SO
4=2Na
2SO
4+3H
2O
2+2CO
2↑+2H
2O 2H
2O
22H
2O+O
2↑
为测定已变质的过碳酸钠(污渍爆炸盐部分变质后的成分为2Na
2CO
3?3H
2O
2和Na
2CO
3)的纯度,设计如图所示的实验:Q为-具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H
2SO
4滴入气球中.
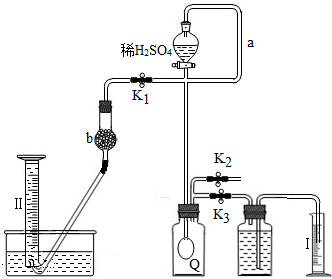
(1)Q内发生反应生成的气体为
.在样品中加入少量二氧化锰的目的是
.导管a作用是
.
(2)为测出反应时生成气体的总体积,滴稀H
2SO
4前必须关闭
(填K
1、K
2或K
3,下同).打开
.
(3)当上述反应停止,将K
1、K
2、K
3处于关闭状态,然后先打开K
2,再缓缓打开K
1,这时可观察到的现象是
,b中装的碱石灰的作用是
,为何要缓缓打开K
1的理由是
.
(4)实验结束时,量筒I中有123.4mL水,量筒Ⅱ中收集到33.6mL气体(上述体积均已折算到标准状况),则过碳酸钠的纯度是
(保留小数点后一位;标准状况下气体的密度:CO
2-1.96g/L,O
2-1.43g/L).
(5)某同学实验测得的过碳酸钠的纯度偏大,你认为可能的原因是
.
A.气体滞留在Q和导气管中,未全部进入量筒Ⅱ
B.量筒Ⅱ读数时,量筒液面高于水槽液面
C.右侧量筒Ⅰ和储液集气瓶连接导管内的液体没有计入读数x
D.气体体积数值x、y没有扣除滴加的硫酸的体积.