
题目列表(包括答案和解析)
| 实验中可能出现的现象 | 结论 |
| (1) 滤纸上有黑色粉末,滤液为无色 |
假设1成立 |
| (2)滤纸上无黑色粉末,滤液为蓝色 | 假设2成立 |
| (3) 滤纸上有黑色粉末,滤液为蓝色 |
假设3成立 |
| 实验中可能出现的现象 | 结论 |
| ① | 假设1成立 |
| ② | 假设2成立 |
| ③ | 假设3成立 |
| 实验内容 | 实验现象 | 分析与结论 | ||||||||
将充满CO和CO2的试管倒置于滴有紫色石蕊的水中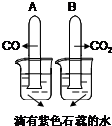 |
A试管内无明显现象, B试管内液体变为 红 红 色,试管内液面上升. |
结论: CO难溶于水且不与水反应 CO2能溶于水且可与水反应. | ||||||||
将充满CO和CO2的试管倒置于入饱和石灰水中 |
C试管中无明显现象. D试管中可观察到 澄清的石灰水变浑浊,试管内液面上升 澄清的石灰水变浑浊,试管内液面上升 . |
结论: CO不能与碱溶液反应, CO2能与碱溶液反应. | ||||||||
将两根灼热、表面已氧化变黑的铜丝分别伸入充满CO和CO2的试管中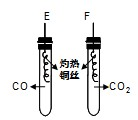 |
E中可观察到灼热的铜丝表面 由黑色变为红色 由黑色变为红色 ,F中无明显现象. |
CO与CuO反应的化学方程式为 CO+CuO
CO+CuO ,
结论: CO具有还原性, CO2无还原性. |
 在小烧杯A中加入20mL蒸馏水,滴入2~3滴紫色石蕊试液,得到的溶液呈紫色.在小烧杯B中加入20mL浓盐酸(盐酸是氯化氢气体溶于水形成的溶液);用一只大烧杯把A、B两个烧杯罩在一起(如图所示).过几分钟,看到烧杯A中的溶液变成红色.
在小烧杯A中加入20mL蒸馏水,滴入2~3滴紫色石蕊试液,得到的溶液呈紫色.在小烧杯B中加入20mL浓盐酸(盐酸是氯化氢气体溶于水形成的溶液);用一只大烧杯把A、B两个烧杯罩在一起(如图所示).过几分钟,看到烧杯A中的溶液变成红色.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com