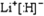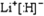某课外兴趣小组对双氧水(H
2O
2水溶液)做了如下实验探究.
(1)将质量相同但聚集状态不同的MnO
2分别加入5mL 5%的双氧水中,并用带火星的木条试之.测定结果如下:
| 催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
| 粉末状 |
混合不振荡 |
剧烈反应,使木条复燃 |
3.5分钟 |
| 块状 |
|
反应较慢,火星红亮但木条未复燃 |
30分钟 |
①写出H
2O
2反应的化学方程式
.
②实验结果说明催化剂作用的大小与
催化剂的表面积
催化剂的表面积
有关.
(2)取三份含有等量H
2O
2,但质量分数不同的双氧水,分别向其中加入1克MnO
2粉末.测定结果如下:
| 双氧水体积 |
操作情况 |
反应完成所需的时间 |
收集到气体体积 |
反应后液体温度 |
| a1%的150mL |
|
11分钟 |
539mL |
24℃ |
| a2%的15mL |
混合不振荡 |
1分20秒 |
553mL |
56℃ |
| a3%的7.5mL |
|
9秒 |
562mL |
67℃ |
请简要说明:
①反应完成所需的时间不同的原因
溶液质量分数不同,液体温度不同
溶液质量分数不同,液体温度不同
.
②反应后液体温度不同的原因
反应放热相同,但液体的量不同
反应放热相同,但液体的量不同
.
③收集到气体体积不同的原因
液体的量不同,液体温度不同(影响气体在溶液中的溶解量)
液体的量不同,液体温度不同(影响气体在溶液中的溶解量)
.
(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去.
①已知双氧水显弱酸性,试写出H
2O
2的电离方程式:
H2O2 ?HO2-+H+
H2O2 ?HO2-+H+
.
②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致.请你设计一个简单实验来说明是甲对还是乙对.(简要文字说明)
在褪色溶液中再逐滴加入NaOH溶液,若红色恢复说明甲对,若红色不恢得则说明乙对
在褪色溶液中再逐滴加入NaOH溶液,若红色恢复说明甲对,若红色不恢得则说明乙对
.