
题目列表(包括答案和解析)
有关溶液的计算
1.判断反应前后溶液质量的变化及变化量.
2.溶液中溶质质量分数的计算中,涉及溶液体积的计算.计算依据:溶液质量=溶液体积×________;溶液密度×________×________=溶质的质量
3.溶液稀释浓缩的相关计算
溶液增浓有三种方法:一种是补充________;一种是蒸发________;另一种是加入高浓度溶液.计算依据:稀释或浓缩前后溶质的质量相等.
4.有溶质的质量分数与化学方程式的综合计算
在根据化学方程式进行计算时,因为代入化学方程式的都是纯净物的质量,所以,如果是溶液,只能代入溶质,计算出的也是纯净物的质量.对于反应后所得溶液的质量有两种求法:
①溶液组成法:溶液质量=溶质质量+溶剂质量,其中溶质一定是被溶解的且没有与水发生反应,溶剂水通常有两种:A.原溶液中的水,B.化学反应新生成的水.
②质量守恒:溶液质量=进入液体的固体质量(包括由于反应进入和直接溶入的)+液体质量-________-________.
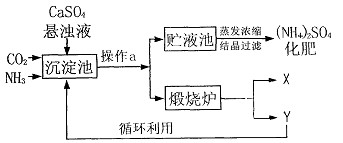
 Na2SO4+2NH3↑+2H2O,氨气极易溶于水,其水溶液为氨水。氨水呈碱性,不稳定,易挥发。
Na2SO4+2NH3↑+2H2O,氨气极易溶于水,其水溶液为氨水。氨水呈碱性,不稳定,易挥发。
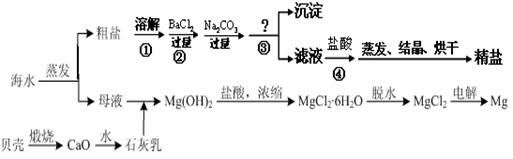
通过海水晾晒可得粗盐和母液,粗盐除NaCl外,还含有CaCl2、Na2SO4以及泥沙等杂质。海水可同时生产氯化钠和金属镁或镁的化合物等产品,其流程如下图所示:
(1)制得粗盐和精盐的操作都包括蒸发步骤,有关其中“蒸发”步骤的叙述错误的是________。
a. 蒸发的目的是得到热饱和溶液 b. 蒸发的目的是析出晶体
c. 应用余热蒸干溶液 d. 应蒸发至有较多晶体析出时为止
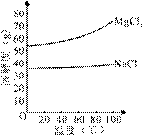
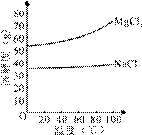
(2)由MgCl2溶液得到MgCl2·6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是_________。(填写“得到热饱和溶液”或“析出晶体”)
(3)在第①步粗盐溶解操作中要用玻璃棒搅拌,其作用是 ;第②步加试剂的目的是除去粗盐中的 (填化
学式),第④步加入盐酸的目的是 。
(4)该流程的副产品中,除钙元素能被海洋生物利用外,还需综合利用的物质是_________。
(5)MgCl2可电解制Mg,MgO则是重要的耐火材料。在550℃时,MgCl2·6H2O会分解生成MgO、MgCl2、HCl和水,其中MgO、MgCl2的物质的量
之比为3:1,该反应的化学方程式为
;若不补充其它原料,还可制得溶质质量分数为_______%的盐酸。(计算结果精确到0.1)
(6)电解食盐水所得溶液中的溶质主要为氢氧化钠和氯化钠(其它溶质可忽略不计),已测得该溶液的密度为1.2 g/mL,为进一步测定其中氢氧化钠的含量,取该溶液样品25 mL与10%的稀硫酸反应,当加入49g稀硫酸时恰好完全中和。请根据化学方程式列式计算:
①25 mL该溶液样品中含氢氧化钠多少克?
②该溶液样品中氢氧化钠的质量分数是多少?
通过海水晾晒可得粗盐和母液,粗盐除NaCl外,还含有CaCl2、Na2SO4以及泥沙等杂质。海水可同时生产氯化钠和金属镁或镁的化合物等产品,其流程如下图所示:
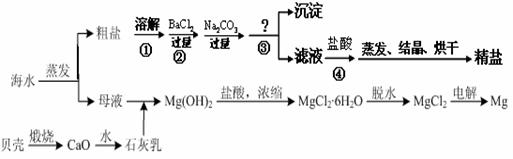
(1)制得粗盐和精盐的操作都包括蒸发步骤,有关其中“蒸发”步骤的叙述错误的是________。
a. 蒸发的目的是得到热饱和溶液 b. 蒸发的目的是析出晶体
c. 应用余热蒸干溶液 d. 应蒸发至有较多晶体析出时为止
(2)由MgCl2溶液得到MgCl2·6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是_________。(填写“得到热饱和溶液”或“析出晶体”)
(3)在第①步粗盐溶解操作中要用玻璃棒搅拌,其作用是 ;第②步加试剂的目的是除去粗盐中的 (填化学式),第④步加入盐酸的目的是 。
(4)该流程的副产品中,除钙元素能被海洋生物利用外,还需综合利用的物质是_________。
(5)MgCl2可电解制Mg,MgO则是重要的耐火材料。在550℃时,MgCl2·6H2O会分解生成MgO、MgCl2、HCl和水,其中MgO、MgCl2的物质的量之比为3:1,该反应的化学方程式为
;若不补充其它原料,还可制得溶质质量分数为_______%的盐酸。(计算结果精确到0.1)
(6)电解食盐水所得溶液中的溶质主要为氢氧化钠和氯化钠(其它溶质可忽略不计),已测得该溶液的密度为1.2 g/mL,为进一步测定其中氢氧化钠的含量,取该溶液样品25 mL与10%的稀硫酸反应,当加入49g稀硫酸时恰好完全中和。请根据化学方程式列式计算:
①25 mL该溶液样品中含氢氧化钠多少克?
②该溶液样品中氢氧化钠的质量分数是多少?
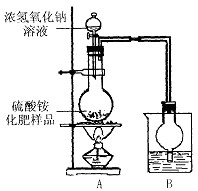
牙膏是生活必需品,某兴趣小组同学对某品牌市售牙膏展开如下探究,请回答问题:
 【资料卡片】:
【资料卡片】:
a、SiO2不溶于水、且不与酸反应,高温不分解;
b、NaHCO3受热易分解,生成Na2CO3、H2O、CO2;
c、牙膏中保湿剂、增稠剂、香精等均为有机物。
(1)取一小段牙膏,加入蒸馏水,充分搅拌后静置,测得其上层清液的pH为8.3,则此牙膏显 ▲ 性,实验室能否用pH试纸测得该数值,请你作出判断并说明理由。 ▲ ;
(2)小岳同学发现,此品牌牙膏在冬季会出现颗粒变大的现象。资料显示是牙膏中的K12(一种钠盐)析出,则K12的溶解度和温度的关系是 ▲ ;
(3)为测定此牙膏中SiO2的质量分数,兴趣小组同学设计了如下方案,并进行了3次实验:
【实验步骤】:
①准确称取2.0g牙膏膏体,烘干水分,高温加热,至质量不再减轻为止,在干燥器中冷却至
 室温;
室温;
②转移剩余物至烧杯中,加入稀HCl,至 ▲ ;
③过滤、洗涤、称量得到剩余固体质量(如右表);
④根据实验数据进行计算。
【数据处理】:
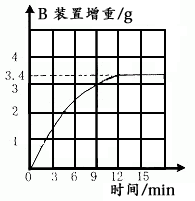
(4)此测定做3次实验的目的是 ▲ ;
(5)综合上述实验方案及实验数据,计算此牙膏中SiO2的质量分数。(2分) ▲ ;
【实验分析】:
(6)按上述实验步骤操作,发现测定结果偏大,导致偏大的原因可能是 ▲ ;
(7)高温加热的目的除为了除去CaCO3及NaHCO3以外,还为除去 ▲ ;
(8)步骤②中,加稀HCl发生的反应有 ▲ 、 ▲ ;
(9)步骤③中,洗涤的目的是 ▲ ;若不洗涤,则测定结果将 ▲ 。(填“偏大”、“偏小”或“不变”)
(10)为保证洗涤效果,最好用 ▲ 洗涤。
A.蒸馏水 B.自来水 C.饱和NaCl溶液 D.饱和CaCl2溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com