
题目列表(包括答案和解析)
科学探究是奇妙的过程,请你一起参与实验探究 ,并填写下列空白:(6分)
,并填写下列空白:(6分)
小明参观某养鱼池时,好奇的发现 农民向养鱼池中撒一种叫做过氧化钙的淡黄色固体,用来增加鱼池中的含氧量。小明刚学完氧气的实验室制法,于是他想可否用
农民向养鱼池中撒一种叫做过氧化钙的淡黄色固体,用来增加鱼池中的含氧量。小明刚学完氧气的实验室制法,于是他想可否用
【提出问题】过氧化钙可否用于制取氧气?
【查阅资料】部分内容如下:过氧化钙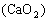 室温下稳定,在300℃时分解生成氧气,可做增氧剂、杀菌剂等。
室温下稳定,在300℃时分解生成氧气,可做增氧剂、杀菌剂等。
【猜想与论证】
(1)小明依据______________,提出猜想Ⅰ。
 (2)小明联想到农民用过氧化钙增加鱼池中的含氧量,提出猜想Ⅱ。
(2)小明联想到农民用过氧化钙增加鱼池中的含氧量,提出猜想Ⅱ。
猜想Ⅱ:过氧化钙与水反应可制取氧气。
| 实验装置 | 实验主要过程 |
|
| ①检验装置气密性。 ②加入过氧化钙和水后,有少量细小气 |
实验结论:实验室不能用过氧化钙与水反应制取氧气。
分析与反思:
①虽然没有快速收集到大量氧气,但由此实验现象,小明认为农民用过氧化钙做增氧剂的主要原因是_______________ _________________。
_________________。
②小明希望对此实验进行改进,使该反应加快,你能帮他提出建议吗?
你的合理建议:________________________。
以上建议是否可行,还需进一步通过实验验证。
大龙在公园看到绿化工人往树干上涂抹具有杀菌杀虫作用的悬浊液,对其成份产生了好奇,于是他带回了一些样本进行研究。
信息提示:许多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这叫做焰色反应。如:钠——黄色;钙——砖红色;钾——紫色;钡——黄绿色
Ⅰ猜想与假设:该制剂可能为波尔多液
Ⅱ实验探究:
| 序号 | 实验步骤 | 实验现象 |
| ① | 取样,将其置于大试管中,加入一定量水,静置片刻 | 上层有黄色固体漂浮,中层为无色液体,下层有较多白色固体 |
| ② | 取少量中层液体滴加无色酚酞试液 | 无色酚酞试液变红 |
| ③ | 另取少量中层液体进行焰色反应 | 火焰呈现砖红色 |
| ④ | 取少量黄色固体灼烧 | 燃烧,放热,产生淡蓝色火焰,有刺激性气味 |
| ⑤ | 向下层白色固体中滴加足量稀盐酸 | 固体完全溶解,但仅产生少量气泡 |
Ⅲ实验结论:
(1)根据上述实验①,可以判断该悬浊液中 ▲ (填“含”或“不含”)硫酸铜;
(2)根据上述实验 ▲ (填序号),可以判断该悬浊液中含有氢氧化钙;
(3)根据上述实验④,可以判断黄色固体是 ▲ ;
(4)写出⑤中发生的所有反应的化学方程式: ▲ 。
答案:(1)不含 (2)②③ (3)硫(或硫磺)(各1分)
(4)Ca(OH)2+2HCl=CaCl2+2H2O CaCO3+2HCl=CaCl2+H2O+C02↑(各2分)
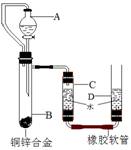
4.(2009常州市)小黄用右图装置测定铜锌合金中锌的质量分数和锌的相对原子质量。主要实验步骤如下(必要的固定装置已略去):

①连接装置并检查装置气密性;
②加入药品和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加试剂至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥将B中剩余固体过滤、洗涤、干燥并称重,称得剩余固体质量为W g。
(1)A仪器的名称为 ▲ ;
(2)B中发生的反应的化学方程式为: ▲ ;
(3)小黄在实验前将块状的铜锌合金磨成粉末状,其目的是: ▲ ;
(4)如何检验该装置的气密性: ▲ ;
(5)为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平外,还应 ▲ ;
(6)小黄发现实验中由于缺少某一步骤导致数据缺乏而无法计算,该步骤是: ▲ ;
(7)通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验: ▲ ;理由是 ▲ 。
| 序号 | 实验步骤 | 实验现象 |
| ① | 取样,将其置于大试管中,加入一定量水,静置片刻 | 上层有黄色固体漂浮,中层为无色液体,下层有较多白色固体 |
| ② | 取少量中层液体滴加无色酚酞试液 | 无色酚酞试液变红 |
| ③ | 另取少量中层液体进行焰色反应 | 火焰呈现砖红色 |
| ④ | 取少量黄色固体灼烧 | 燃烧,放热,产生淡蓝色火焰,有刺激性气味 |
| ⑤ | 向下层白色固体中滴加足量稀盐酸 | 固体完全溶解,但仅产生少量气泡 |

大龙在公园看到绿化工人往树干上涂抹具有杀菌杀虫作用的悬浊液,对其成份产生了好奇,于是他带回了一些样本进行研究。
信息提示:许多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这叫做焰色反应。如:钠——黄色;钙——砖红色;钾——紫色;钡——黄绿色
Ⅰ猜想与假设:该制剂可能为波尔多液
Ⅱ实验探究:
|
序号 |
实验步骤 |
实验现象 |
|
① |
取样,将其置于大试管中,加入一定量水,静置片刻 |
上层有黄色固体漂浮,中层为无色液体,下层有较多白色固体 |
|
② |
取少量中层液体滴加无色酚酞试液 |
无色酚酞试液变红 |
|
③ |
另取少量中层液体进行焰色反应 |
火焰呈现砖红色 |
|
④ |
取少量黄色固体灼烧 |
燃烧,放热,产生淡蓝色火焰,有刺激性气味 |
|
⑤ |
向下层白色固体中滴加足量稀盐酸 |
固体完全溶解,但仅产生少量气泡 |
Ⅲ实验结论:
(1)根据上述实验①,可以判断该悬浊液中 ▲ (填“含”或“不含”)硫酸铜;
(2)根据上述实验 ▲ (填序号),可以判断该悬浊液中含有氢氧化钙;
(3)根据上述实验④,可以判断黄色固体是 ▲ ;
(4)写出⑤中发生的所有反应的化学方程式: ▲ 。
答案:(1)不含 (2)②③ (3)硫(或硫磺)(各1分)
(4)Ca(OH)2+2HCl=CaCl2+2H2O CaCO3+2HCl=CaCl2+H2O+C02↑(各2分)
4.(2009常州市)小黄用右图装置测定铜锌合金中锌的质量分数和锌的相对原子质量。主要实验步骤如下(必要的固定装置已略去):
①连接装置并检查装置气密性;
②加入药品和水;
③记录C中液面刻度(C为带有刻度的玻璃管);
④由A向B中滴加试剂至过量;
⑤待B中不再有气体产生并恢复至室温后,记录C中液面刻度,计算得到气体的体积为V mL(经查,该气体密度为ρg/L);
⑥将B中剩余固体过滤、洗涤、干燥并称重,称得剩余固体质量为W g。
(1)A仪器的名称为 ▲ ;
(2)B中发生的反应的化学方程式为: ▲ ;
(3)小黄在实验前将块状的铜锌合金磨成粉末状,其目的是: ▲ ;
(4)如何检验该装置的气密性: ▲ ;
(5)为使测得的气体体积更精确,记录C中液面刻度时,除使视线与凹液面的最低处相平外,还应 ▲ ;
(6)小黄发现实验中由于缺少某一步骤导致数据缺乏而无法计算,该步骤是: ▲ ;
(7)通常实验前须估算药品用量,如果实验过程中,发现盐酸的量不足,应中途加酸还是重新实验: ▲ ;理由是 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com