
题目列表(包括答案和解析)
(16分)某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究.填写下列空白:
(1)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因I:Cl-对反应具有促进作用,而 对反应没有影响;[来源:ZXXK]
对反应没有影响;[来源:ZXXK]
原因II:___________________________________;
原因III:Cl-对反应具有促进作用,而 对反应具有阻碍作用;
对反应具有阻碍作用;
原因IV:Cl-、 均对反应具有促进作用,但Cl-影响更大;
均对反应具有促进作用,但Cl-影响更大;
原因V:____________________________________________________
(2)该同学设计并进行了两组实验,即得出了正确的结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和稀盐酸的试管(两试管的规格相同)中:
①在盛有稀硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
②在盛有稀盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。若观察到实验1中_________,实验2中__________,则说明原因III是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
(3)为了使实验“定量化”,使结果更精确,可以对实验进行如下改进:
①配制c(H+)相同的稀盐酸和稀硫酸:现有浓度为1mol·L-1的盐酸和密度为1.225g·cm-3、质量分数为20%的硫酸,若要准确量取该硫酸20.00mL,需要用________(填仪器名称);将量取的硫酸配制成c(H+)=1mol·L-1的溶液,可得溶液的体积为____________。
配制溶液时还需要用到的玻璃仪器有_____________、__________、烧杯、胶头滴管和量筒等。
②比较反应速率:反应时间可以用秒表测定。如果要对上述实验中的反应速率进行比较,可以通过测定哪些物理量来确定?要求回答一种即可。
某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究.填写下列空白:
(1)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因I:Cl-对反应具有促进作用,而![]() 对反应没有影响;
对反应没有影响;
原因II:___________________________________;
原因III:Cl-对反应具有促进作用,而![]() 对反应具有阻碍作用;
对反应具有阻碍作用;
原因IV:Cl-、![]() 均对反应具有促进作用,但Cl-影响更大;
均对反应具有促进作用,但Cl-影响更大;
原因V:____________________________________________________
(2)该同学设计并进行了两组实验,即得出了正确的结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和稀盐酸的试管(两试管的规格相同)中:
①在盛有稀硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
②在盛有稀盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。若观察到实验1中_________,实验2中__________,则说明原因III是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
(3)为了使实验“定量化”,使结果更精确,可以对实验进行如下改进:
①配制c(H+)相同的稀盐酸和稀硫酸:现有浓度为1mol·L-1的盐酸和密度为1.225g·cm-3、质量分数为20%的硫酸,若要准确量取该硫酸20.00mL,需要用________(填仪器名称);将量取的硫酸配制成c(H+)=1mol·L-1的溶液,可得溶液的体积为____________。
配制溶液时还需要用到的玻璃仪器有_____________、__________、烧杯、胶头滴管和量筒等。
②比较反应速率:反应时间可以用秒表测定。如果要对上述实验中的反应速率进行比较,可以通过测定哪些物理量来确定?要求回答一种即可。
(16分)某同学发现,纯度、质量、表面积都相同的两铝片与c(H+)浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝与盐酸反应速率更快。他决定对其原因进行探究.填写下列空白:
(1)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因I:Cl-对反应具有促进作用,而![]() 对反应没有影响;
对反应没有影响;
原因II:___________________________________;
原因III:Cl-对反应具有促进作用,而![]() 对反应具有阻碍作用;
对反应具有阻碍作用;
原因IV:Cl-、![]() 均对反应具有促进作用,但Cl-影响更大;
均对反应具有促进作用,但Cl-影响更大;
原因V:____________________________________________________
(2)该同学设计并进行了两组实验,即得出了正确的结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和稀盐酸的试管(两试管的规格相同)中:
①在盛有稀硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
②在盛有稀盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。若观察到实验1中_________,实验2中__________,则说明原因III是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
(3)为了使实验“定量化”,使结果更精确,可以对实验进行如下改进:
①配制c(H+)相同的稀盐酸和稀硫酸:现有浓度为1mol·L-1的盐酸和密度为1.225g·cm-3、质量分数为20%的硫酸,若要准确量取该硫酸20.00mL,需要用________(填仪器名称);将量取的硫酸配制成c(H+)=1mol·L-1的溶液,可得溶液的体积为____________。
配制溶液时还需要用到的玻璃仪器有_____________、__________、烧杯、胶头滴管和量筒等。
②比较反应速率:反应时间可以用秒表测定。如果要对上述实验中的反应速率进行比较,可以通过测定哪些物理量来确定?要求回答一种即可。
| 信息卡 常温下碳酸钙难溶于水,氢氧化钙微溶于水,氯化钙易溶于水.次氯酸钙易溶于水,酸性条件下不稳定、100°C时发生分解反应. 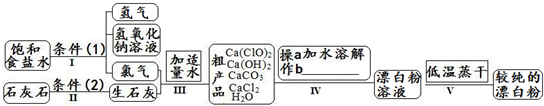 (1)流程I 得到浓度为80g?L-1氢氧化钠溶液,其物质的量浓度是 2 2 mol?L-1.(2)写出流程I发生反应的化学反应方程式,并用双线桥表示其电子转移的方向和数目:   高温 高温 .(3)流程III中发生两个反应,写出其中的氧化还原反应的化学反应方程 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O 2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O .其中氧化剂是Cl2 Cl2 ;还原剂是Cl2 Cl2 .(写化学式)(4)流程IV中操作b是: 过滤 过滤 .(写名称)(5)流程V进行低温蒸干的原因是: Ca(ClO)2在100°C时发生分解反应 Ca(ClO)2在100°C时发生分解反应 .(6)用化学方程式说明较纯的次氯酸钙粉末必须密封保存的原因 Ca(ClO)2+CO2+H2O═CaCO3+2HClO Ca(ClO)2+CO2+H2O═CaCO3+2HClO .(7)氯水和次氯酸钙都能起漂白、消毒作用.是因为它们都能产生同一种物质,写出氯气与水反应产生该物质的化学方程式 Cl2+H2O  HCl+HClO HCl+HClOCl2+H2O . HCl+HClO HCl+HClO(8)在酸性条件下次氯酸钙的氧化性比氯气强,能将溴离子氧化成溴单质,而次氯酸钙中的氯元素则被还原为负一价的氯离子,氧元素则转化为水.试写出次氯酸钙和稀盐酸的混合物与溴化钠反应的化学方程式: Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O Ca(ClO)2+4HCl+4NaBr=CaCl2+4NaCl+2Br2+2H2O .
化合物IV为一种重要化工中间体,其合成方法如下:
(1)化合物I的化学式为 ;化合物IV除了含有-Br还有的官能团是 。 (2)化合物II具有卤代烃的性质,在一定条件下能生成烯,该反应条件是 。 (3)1mol化合物III与足量NaOH反应消耗NaOH的物质的量为 mol。 (4)化合物IV能发生酯化反应生成六元环化合物V,写出该反应的化学方程式: 。 (5)根据题给化合物转化关系及相关条件,请你推出
同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |