
题目列表(包括答案和解析)
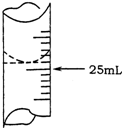 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol?L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
| 1 |
| 2 |
| 1 |
| 2 |
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)盖斯定律在生产和科学研究中有很重要的意义。已知把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
则△H1、△H2、△H3、△H4的数学关系式是 。
(4分)欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用酚酞作指示剂)。
请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为 ;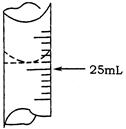
(2)乙学生做了三组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
(3分)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:298K时,
C(s,石墨)+ O2(g)= CO2(g) △H1= -393.5kJ/mol
2H2(g)+ O2(g)==2H2O (l) △H2= -571.6kJ/mol
2C2H2(g)+ 5O2(g)==4CO2(g) + 2H2O (l) △H3= -2599kJ/mol
写出298K时C(s,石墨)和H2(g)生成1mol C2H2(g)的热化学反应方程式:_____________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com