
题目列表(包括答案和解析)
| 实验步骤 | 实验结论 |
| (1)称取A 4.5g,加热使其汽化,测其密度是相同条件下H2的45倍. | (1)A的相对分子质量为 90 90 |
| (2)将此4.5gA在足量O2中充分燃烧,并使其产物依次缓缓通过盛有足量浓硫酸、氢氧化钠溶液的洗气瓶,发现两者分别增重2.7g和6.6g. | (2)A的分子式为 C3H6O3 C3H6O3 |
| (3)另取A 4.5g,跟足量的NaHCO3粉末反应,生成1.12L CO2,若与足量金属钠反应则生成1.12LH2(气体体积均在标准状况下测定). | (3)用结构简式表示A中含有的官能团: -OH -OH 、-COOH -COOH . |
(4)A的核磁共振氢谱如图: |
(4)A的结构简式为:   |
(11分)
有机物A仅含有C、H、O三种元素,常温下为无色粘稠液体,易溶于水。为研究A的组成与结构,化学研究性学习小组进行了如下实验:
| 实验步骤 | 实验结论 |
| (1)称取A 4.5kg,加热使其汽化,测其密度是相同条件下H2的45倍。 | (1)A的相对分子质量为 90 |
| (2)将此4.5gA在足量O2中充分燃烧,并使其产物依次缓缓通过盛有足量浓硫酸、氢氧化钠溶液的洗气瓶,发现两者分别增重2.7g和6.6g。 | (2)A的分子式为 |
| (3)另取A 4.5g,跟足量的NaHCO3粉末反应,生成1.12LCO2,若与足量金属钠反应则生成1.12LH2(气体体积均在标准状况下测定)。 | (3)用结构简式表示A中含有的官能团:
|
| (4)A的1H核磁共振氢谱如下图:
| (4)A的结构简式为 |
(9分)A、B、C、D是中学化学中常见的四种化合物,它们分别由两种元素组成.甲、乙、丙是单质,甲、丙、A、C、D常温下均为气体,B为液体.这些单质和化合物之间存在如下关系:
(1)写出下列物质的分子式:A_______ 甲_______、丙_______.
(2)写出单质甲跟化合物C反应,生成SO2和化合物B的化学方程式_____________.
(3)标准状况下将28L化合物A与足量的过氧化钠充分反应转移电子的数目为
(4)在密闭容器中,化合物B跟化合物D在高温下生成化合物A和单质丙的反应是可逆反应,其化学方程式为__________。
(5)化合物C的稳定性比化合物B (填强或弱)。
【解析】本题属于无机框图题,关键是寻找突破点。常见的液体是水,则B是水。单质和化合物反应生成SO2和水的反应,根据原子守恒可知甲应是氧气,C是H2S。单质和气态化合物反应生成另外一种气态化合物的,常见的是CO2和C的反应生成CO,因此A是CO2,D是CO,乙是C。CO在高温下和水蒸气反应又生成CO2和氢气,所以丙是氢气。
(1)(2)(4)略
(3)28LCO2的物质的量是![]() 。CO2和过氧化钠反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,在反应中过氧化钠既是氧化剂也是还原剂,转移的电子是2,所以当消耗1.25mol是转移的电子数目为1.25NA。
。CO2和过氧化钠反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,在反应中过氧化钠既是氧化剂也是还原剂,转移的电子是2,所以当消耗1.25mol是转移的电子数目为1.25NA。
(5)S的非金属性弱于O的,所以H2S的稳定性弱于H2O的。
(9分)A、B、C、D是中学化学中常见的四种化合物,它们分别由两种元素组成.甲、乙、丙是单质,甲、丙、A、C、D常温下均为气体,B为液体.这些单质和化合物之间存在如下关系:
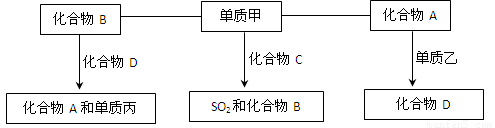
(1)写出下列物质的分子式:A_______ 甲_______、丙_______.
(2)写出单质甲跟化合物C反应,生成SO2和化合物B的化学方程式_____________.
(3)标准状况下将28L化合物A与足量的过氧化钠充分反应转移电子的数目为
(4)在密闭容器中,化合物B跟化合物D在高温下生成化合物A和单质丙的反应是可逆反应,其化学方程式为__________。
(5)化合物C的稳定性比化合物B (填强或弱)。
【解析】本题属于无机框图题,关键是寻找突破点。常见的液体是水,则B是水。单质和化合物反应生成SO2和水的反应,根据原子守恒可知甲应是氧气,C是H2S。单质和气态化合物反应生成另外一种气态化合物的,常见的是CO2和C的反应生成CO,因此A是CO2,D是CO,乙是C。CO在高温下和水蒸气反应又生成CO2和氢气,所以丙是氢气。
(1)(2)(4)略
(3)28LCO2的物质的量是 。CO2和过氧化钠反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,在反应中过氧化钠既是氧化剂也是还原剂,转移的电子是2,所以当消耗1.25mol是转移的电子数目为1.25NA。
。CO2和过氧化钠反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,在反应中过氧化钠既是氧化剂也是还原剂,转移的电子是2,所以当消耗1.25mol是转移的电子数目为1.25NA。
(5)S的非金属性弱于O的,所以H2S的稳定性弱于H2O的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com