
题目列表(包括答案和解析)
| 1、过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解; 2、过碳酸钠分解的化学方程式为2(2 Na2CO3?3 H2O2 )=4 Na2CO3+6 H2O+3O2↑ 3、H2O2分解放出热量,Na2CO3受热不分解;Ⅰ、制备研究:如图1是制备过碳酸钠的工艺流程.  请回答问题: (1)反应器中发生反应的化学方程式为 2Na2CO3+3H2O2═2Na2CO3?3H2O2 2Na2CO3+3H2O2═2Na2CO3?3H2O2 ;(2)生产中,反应及干燥均需在较低温度下进行,原因是 防止过碳酸钠分解,影响产量和产率 防止过碳酸钠分解,影响产量和产率 ;(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为 过碳酸钠在NaCl溶液中溶解度较小,易析出晶体 过碳酸钠在NaCl溶液中溶解度较小,易析出晶体 .(4)操作A的名称是 过滤 过滤 ,若在实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒 玻璃棒 和漏斗 漏斗 ;(5)洗涤过碳酸钠晶体最好选用 B B .A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液 (6)母液可以循环使用,其中主要含有的溶质是 NaCl NaCl 和Na2CO3(或H2O2) Na2CO3(或H2O2) ;Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3?3H2O2的质量分数. 小组同学设计了如图2所示实验装置(部分仪器略去),并进行实验. [实验步骤]:① 检查气密性 检查气密性 ;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中不再产生气体 不再产生气体 时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算.[实验分析及数据处理]: (7)完善实验步骤的相关内容:① 检查气密性 检查气密性 、④不再产生气体 不再产生气体 ;(8)实验中,水的作用是 溶解过碳酸钠,利于其分解 溶解过碳酸钠,利于其分解 ;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是MnO2(或CuO) MnO2(或CuO) (填化学式);(9)实验中, A A ,则开始收集气体;A.刚开始出现气泡时 B.当气泡均匀连续出现时 C.若用带火星木条放在导管口部,复燃时 (10)若量筒中收集到气体的体积是224mL(通常情况下,氧气的密度近似为1.43g?L-1.),计算过碳酸钠样品中2Na2CO3?3H2O2的质量分数[Mr(2Na2CO3?3H2O2)=314、Mr(O2)=32] 95% 95% ;[实验反思]: (11)经过讨论,小组同学一致认为测定结果偏大,可能原因是 滴入的水占据了锥形瓶内的体积,使得O2体积偏大 滴入的水占据了锥形瓶内的体积,使得O2体积偏大 ;(12)量筒中长导管的作用是 起缓冲作用,防止温度降低至室温时,测量结果产生偏差(或防倒吸) 起缓冲作用,防止温度降低至室温时,测量结果产生偏差(或防倒吸) ;(13)有同学提出,装置中原有空气会使测定结果偏大.这种说法是否正确,如不正确,请说明理由. 不正确,装置中原有空气和生成的O2等体积代换 不正确,装置中原有空气和生成的O2等体积代换 ;(14)经过讨论,小组同学一致认为可用下述方案进行测定.方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g.则样品中2Na2CO3?3H2O2的质量分数为 93.6% 93.6% .(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3?3H2O2的质量分数? 想方法测出过碳酸钠和酸反应生成CO2的体积或质量,进而进行计算(或过碳酸钠和氯化钙、氯化钡等溶液生成沉淀质量进行测定 想方法测出过碳酸钠和酸反应生成CO2的体积或质量,进而进行计算(或过碳酸钠和氯化钙、氯化钡等溶液生成沉淀质量进行测定 .(只需给出简要的方案)
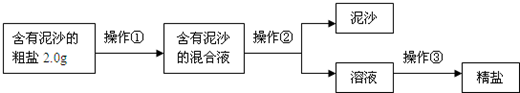
(2012?安庆二模)小刚、小军、小红对久置的NaOH白色粉末的成分开展了以下探究: [提出合理猜想] 猜想①:可能是NaOH 猜想②:可能是Na2CO3 猜想③:可能是NaOH与Na2CO3的混合物 [查阅资料]Na2CO3溶液显碱性,酚酞能使其变红色 [实验探究1] (1)小刚取少量白色粉末于试管中,再滴加稀盐酸,有气泡产生,由此可推出白色粉末中一定含有 Na2CO3 Na2CO3 ,肯定猜想① ① (填序号)是错误的.[实验探究2] (2)小军又取少量白色粉末溶于水,向所得溶液中滴加,溶液变为红色.由此小军结合小刚的实验,认为猜想③是正确的,小红却认为小军的所得结论不确切,因为 Na2CO3溶液也显碱性会使酚酞变红,猜想②也可能正确 Na2CO3溶液也显碱性会使酚酞变红,猜想②也可能正确 .[实验探究3]为探究白色粉末是否含有NaOH,小红设计了如下实验方案:  ①沉淀B的化学式为 BaCO3 BaCO3 ;在操作1中要用到玻璃棒,其作用是搅拌,加快固体溶解 搅拌,加快固体溶解 .②在操作2中,除要用到铁架台(带铁圈)外、烧杯、滤纸、玻璃棒外,还需补充的玻璃仪器 漏斗 漏斗 .[评价与改进] 注意“若答对以下问题,你将奖励4分,但化学试卷总分不超过60分. 小刚认为小红的这个方案也有问题,你认为存在的问题是: 氢氧化钡与碳酸钠反应生成NaOH,影响原固体中NaOH的检验 氢氧化钡与碳酸钠反应生成NaOH,影响原固体中NaOH的检验 .但只要稍加改进,就可以证明粉末中还含有NaOH,你的改进的方法是用BaCl2代替Ba(OH)2 用BaCl2代替Ba(OH)2 .[结论]小刚的实验现象和小红的一致,由此确定猜想③是正确的. 某化学兴趣小组进行溶液的配制和粗盐的初步提纯实验. (1)配制200g质量分数为8%的氢氧化钠溶液: ①计算:需要氢氧化钠固体的质量为 16 16 克,需要水的体积为184 184 mL(水的密度近似看作1g/mL).②称量:调节托盘天平平衡,将一个烧杯放在托盘天平的 左 左 盘,称量其质量.然后BA BA (按操作的先后顺序选填字母),直至天平平衡.A.将氢氧化钠固体加入烧杯中 B.按需要添加砝码、移动游码 该步骤中用烧杯而不用纸称量氢氧化钠的原因是 氢氧化钠具有腐蚀性 氢氧化钠具有腐蚀性 .③用 量筒 量筒 量取所需要的水,倒入盛有氢氧化钠固体的烧杯中,用玻璃棒 玻璃棒 搅拌,使其溶解,并冷却到室温.④将配制好的溶液放入试剂瓶,塞好橡胶塞并 贴上标签 贴上标签 ,放到指定的地方.(2)粗盐的初步提纯: ①称取5.0克粗盐,用药匙逐渐加入到10mL水中,直到粗盐不再溶解为止.还需进行的实验操作步骤的顺序为:称量剩余粗盐、 ACDB ACDB (填编号).A.过滤 B.计算产率 C.蒸发 D.称量精盐 ②过滤操作如图所示,指出其中的错误之处: 未用玻璃棒引流 未用玻璃棒引流 ;滤纸高出漏斗边缘 滤纸高出漏斗边缘 ;滤纸未紧贴漏斗内壁 滤纸未紧贴漏斗内壁 ;漏端尖嘴末端未紧贴烧杯B的内壁(答案无顺序要求,合理即可). 漏端尖嘴末端未紧贴烧杯B的内壁(答案无顺序要求,合理即可).  同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |