某化学兴趣小组在做Al和CuSO
4溶液反应实验时,小明将Al丝插入到盛有CuSO
4溶液的试管中,发现无明显现象,他非常困惑.小芳告述了他,这是因为
铝丝的表面有致密的氧化膜,阻止了铝和硫酸铜的反应
铝丝的表面有致密的氧化膜,阻止了铝和硫酸铜的反应
,并告述了他处理的方法.他按照小芳告述的方法重新做了该实验,但他发现Al丝表面有红色物质析出的同时有气泡产生.这一现象激发了同学们的探究欲望,产生的气体是什么呢?
[提出猜想]该气体可能是SO
2、O
2、H
2中的一种或几种.
同学们猜想该气体可能是SO
2、O
2、H
2中的一种或几种.你认为他们提出该猜想的依据是
质量守恒定律
质量守恒定律
.
[查阅资料]SO
2的性质与CO
2相似.
[设计方案]同学们为验证自己的猜想,设计了如下方案:
(1)小明认为若是O
2,则检验方法是
将带火星的木条伸到试管中(木条不复燃,则不是氧气)
将带火星的木条伸到试管中(木条不复燃,则不是氧气)
.
(2)小芳认为若是SO
2,则只需将产生的气体通过盛有NaOH溶液的洗气瓶中,称量在通气前后洗气瓶的质量,即可验证.
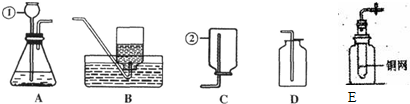
(3)小组同学合作设计了如图所示装置,排除和验证猜想的气体.
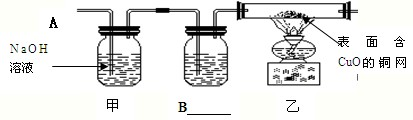
如果产生的是O
2和H
2的混合气体,你认为该方案存在的安全隐患是
点燃(或加热)氢气和氧气的混合气体,则可能发生爆炸
点燃(或加热)氢气和氧气的混合气体,则可能发生爆炸
.为确保安全,他们根据所学知识进行实验.实验证明可用上述装置进行实验.
[实验探究]小组同学首先称量装置甲的质量,再将收集的气体从A通入,过一会儿后点燃乙处的酒精灯;一段时间后,发现表面含有CuO的铜丝网变为光亮的红色;停止加热再停止通气体,再次称量装置甲的质量,发现质量无变化.B瓶中所装试剂为
浓硫酸
浓硫酸
.
[实验结论]Al丝插入到CuSO
4溶液时,产生的气体是
氢气
氢气
.
[实验反思](1)不用称量装置甲的质量,如何判断SO
2与NaOH溶液发生了反应呢?小红设计了如图所示的装置进行实验,发现试管内液面上升,于是他得出SO
2与NaOH溶液发生了反应.小华认为这一方案不严谨,不足以说明SO
2与NaOH溶液确实发生了反应.
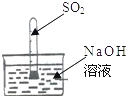
他的理由是
SO2能溶于水,NaOH溶液中含有水,SO2的减少,是SO2溶于水,还是与NaOH反应,该实验无法说明.
SO2能溶于水,NaOH溶液中含有水,SO2的减少,是SO2溶于水,还是与NaOH反应,该实验无法说明.
.要得到科学严谨的结论,小华思考后,仍用该装置,补充了一个实验来回答,这个实验是:
取一只相同的试管,收集满SO2后,倒插入盛水的烧杯中,比较试管中液面上升的高度,即可判断
取一只相同的试管,收集满SO2后,倒插入盛水的烧杯中,比较试管中液面上升的高度,即可判断
.小华采用的是
对比
对比
实验法.这一方法是我们学习化学的一个重要方法.
(2)通过上述实验,该小组同学得出CuSO
4溶液中可能含有的物质是
硫酸
硫酸
.实验后,他们请教实验老师,老师告诉他们:在配制CuSO
4溶液时,为防止溶液浑浊,在溶液中加了少量该物质.


 他的理由是
他的理由是

 (2012?庆云县一模)(1)2007年5月5日,正当人们还在享受“五一”长假的欢乐的时候,从山西临汾传来令人震惊的消息:蒲邓煤矿发生瓦斯爆炸,造成30人死亡.瓦斯的主要成分是甲烷,其化学式为
(2012?庆云县一模)(1)2007年5月5日,正当人们还在享受“五一”长假的欢乐的时候,从山西临汾传来令人震惊的消息:蒲邓煤矿发生瓦斯爆炸,造成30人死亡.瓦斯的主要成分是甲烷,其化学式为