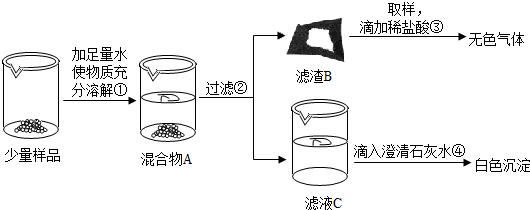
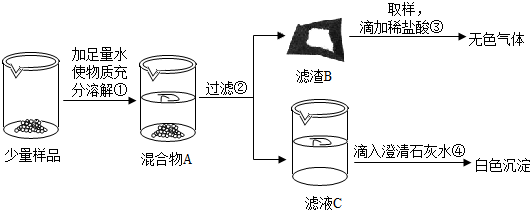
实验室常用的干燥剂“碱石灰”是CaO和NaOH固体的混合物.同学们为确认一瓶久置的“碱石灰”样品的成分,进行如下实验探究.

【查阅资料】①Ca(OH)
2、Na
2CO
3溶于水无明显的温度变化.
②CaCl
2溶液呈中性.
(1)为了使少量样品充分溶解,操作①一定还要用到的玻璃仪器是;滤渣B中一定含有
CaCO3
CaCO3
(填化学式).
(2)滤液C成分的探究.
【猜想】滤液C中的溶质可能为:
①NaOH; ②Na
2CO
3; ③NaOH和Ca(OH)
2; ④NaOH和Na
2CO
3.
【设计方案并进行实验】甲、乙、丙同学分别设计如下方案并进行探究:
甲同学:取少量滤液C放入试管中,滴加足量的稀盐酸,产生大量无色气体,则滤液C中的溶质是Na
2CO
3.
乙同学:取少量滤液C放入试管中,滴加足量的无色酚 酞溶液,溶液变成红色,则滤液C中的溶质一定含有NaOH.
丙同学:取少量滤液C放入试管中,滴加Ca(OH)
2溶液,有白色沉淀产生.向上层清液中滴加无色酚酞溶液,溶液变成红色,则滤液C中的溶质是NaOH和Na
2CO
3.
【反思与评价】丁同学认真分析上述三位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断.他认为滤液C中的溶质一定含有
Na2CO3
Na2CO3
(填化学式),可能含有NaOH.为进一步确认滤液C中是否含NaOH,请你帮助他设计实验进行验证.
(3)实验过程中,同学们还发现向样品中加入足量水溶解时放出大量的热.综合对滤液和滤渣成分的探究,下列对样品成分的分析正确的是
②③
②③
(填序号).
①样品中一定含NaOH
②样品中一定含Na
2CO
3③样品中含NaOH、CaO中的一种或两种.