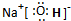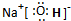A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的
,A、B、D、E这四种元素中,每一种都与C元素形成原子个数比不相同的化合物.
请回答下列问题:
(l)C和E两元素相比较,非金属性较强的是
氧
氧
(填“元素名称”),可以验证该结论的是
CD
CD
(填“序号”).
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)B元素的氢化物在催化剂存在的情况下与C元素单质反应的化学方程式为
.
(3)C、D两元素形成的原子个数比为1:1的化合物,E、C两元素形成的原子个数比为1:2的化合物,该两种化合物反应的化学方程式为
Na2O2+SO2═Na2SO4
Na2O2+SO2═Na2SO4
.
(4)A、C、D、E四种元素可形成两种酸式盐,两种酸式盐相互反应的离子方程式为
HSO3-+H+═SO2↑+H2O
HSO3-+H+═SO2↑+H2O
.
(5)A与C、A与E可分别形成甲、乙两种负一价双原子离子,且甲有10个电子,乙有18个电子,则甲与乙反应的离子方程式为
HS-+OH-═S2-+H2O
HS-+OH-═S2-+H2O
.
(6)B元素的气态氢化物却其一种常见氧化物(双原于分子)能反应生成B的单质,该反应中氧化产物与还原产物的物质的量之比为
2:3
2:3
.