
题目列表(包括答案和解析)
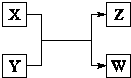 X、Y、Z、W四种物质有如右相互转化关系,X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体;Y、Z是化合物的溶液;Y溶液呈淡绿色.
X、Y、Z、W四种物质有如右相互转化关系,X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体;Y、Z是化合物的溶液;Y溶液呈淡绿色.
| ||
| ||
- 3 |
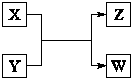 X、Y、Z、W四种物质有如右相互转化关系,X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体;Y、Z是化合物的溶液;Y溶液呈淡绿色.
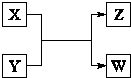
X、Y、Z、W四种物质有如右相互转化关系,X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体;Y、Z是化合物的溶液;Y溶液呈淡绿色.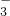 、Cl-、I-中的一种或几种离子,向该溶液中加入W,W被还原,由此可推断溶液中一定含有______离子;一定不含有______离子.
、Cl-、I-中的一种或几种离子,向该溶液中加入W,W被还原,由此可推断溶液中一定含有______离子;一定不含有______离子.| -3 |
有X、Y、Z、W、M、N六种短周期元素,其中X、Y、Z、W同周期,Z与M、N与Y分别同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。
元素X与 M形成X2M2型化合物中阴阳离子个数比为:____________
YM2晶体属于_____________晶体(填晶体类型);30g YM2晶体中含_________条共价键(阿伏加德罗常数用NA表示)
在工业上常用电解饱和XW的溶液来制碱。若用阴极室产生的气体为碱性燃料电池的燃料,则燃料电池中该气体所在电极为_______极,电极反应式为:_________________。
已知单质A为常见黑色固体粉末,B是元素Z的最高价含氧酸,其存在如图所示的转换关系:
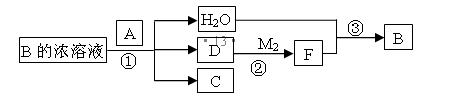
(I) 若向C中滴加KSCN溶液立即呈血红色。则:常温下A在B的浓溶液中难以溶解的原因是 ;因此反应①的的条件是 。在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 ;
(II) 按要求写方程式:
写出反应②的化学方程式 ,
写出C与小苏打溶液反应的离子方程式 ,
(III) 若A是元素N的单质写出反应①的化学方程式:___________________。
有X、Y、Z、W、M、N六种短周期元素,其中X、Y、Z、W同周期,Z与M、N与Y分别同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1) 元素X与 M形成X2M2型化合物中阴阳离子个数比为:____________
(2) YM2晶体属于_____________晶体(填晶体类型);30g YM2晶体中含_________条共价键(阿伏加德罗常数用NA表示)
(3) 在工业上常用电解饱和XW的溶液来制碱。若用阴极室产生的气体为碱性燃料电池的燃料,则燃料电池中该气体所在电极为_______极,电极反应式为:_________________。
(4) 已知单质A为常见黑色固体粉末,B是元素Z的最高价含氧酸,其存在如图所示的转换关系:
(I) 若向C中滴加KSCN溶液立即呈血红色。则:常温下A在B的浓溶液中难以溶解的原因是 ;因此反应①的的条件是 。在工业上反应③是在___________(填设备)中进行的;在实验室用________(填药品名)检验D的存在;含D的尾气直接排放到大气中造成环境污染的后果是 ;
(II) 按要求写方程式:
写出反应②的化学方程式 ,
写出C与小苏打溶液反应的离子方程式 ,
(III) 若A是元素N的单质写出反应①的化学方程式:___________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com