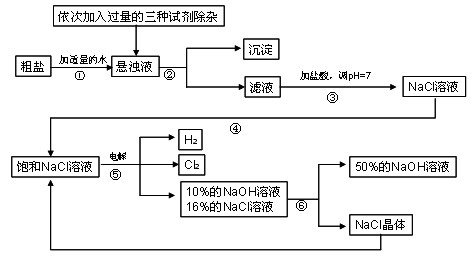
(3)在电解过程中,发生的反应为2NaCl + 2H
2O

Cl
2 ↑+ H
2 ↑ + 2NaOH,电解后溶液的pH__________。(填“升高”、“不变”、“降低”)
(4) 电解食盐水时,需防止Cl
2和NaOH反应,因Cl
2和NaOH溶液充分接触会生成NaClO、氯化钠、水,请写出Cl
2和NaOH溶液反应的化学方程式____________。
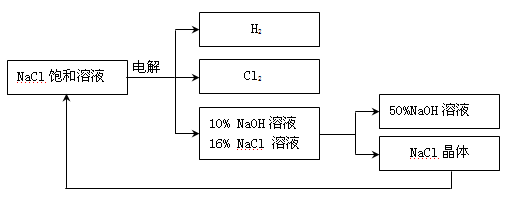
(5)该流程中可以循环利用的物质是 _______________。
(6)若取100g的溶质质量分数为25%的氯化钠溶液进行电解,一段时间后停止通电,生成氯气的质量7.1g。请计算:生成氢气的质量为多少克?反应后溶液中NaOH的质量分数是多少?(写出计算过程,计算结果精确到0.1%)_______________
(7)若使(6)中电解后的溶液恢复到原来状态,则需向溶液中加入适量的____________ 。


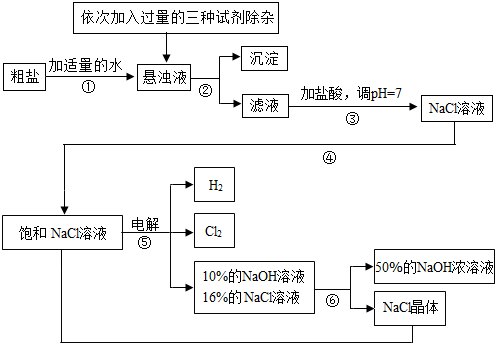
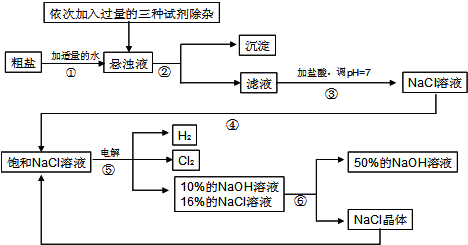
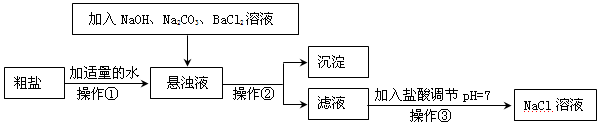
 Cl2 ↑+ H2 ↑ + 2NaOH,电解后溶液的pH__________。(填“升高”、“不变”、“降低”)
Cl2 ↑+ H2 ↑ + 2NaOH,电解后溶液的pH__________。(填“升高”、“不变”、“降低”)