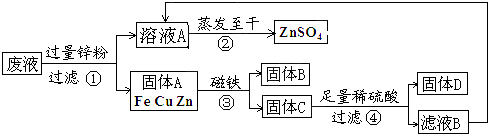
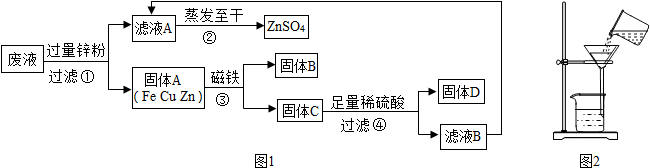
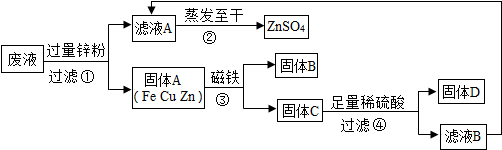
(2011?滨州)某化学实验小组实验结束时,将含有CuSO
4、ZnSO
4、FeSO
4的废液倒在废液缸里,为回收有关金属和盐,同学们设计了如图的实验方案:

试回答:
(1)步骤①中锌粉必须过量的原因是
将废液中的Cu2+和Fe2+全部置换出来
将废液中的Cu2+和Fe2+全部置换出来
.
(2)写出步骤①中任一反应的化学方程式
Zn+CuSO4=ZnSO4+Cu(或Fe+CuSO4═Cu+FeSO4)
Zn+CuSO4=ZnSO4+Cu(或Fe+CuSO4═Cu+FeSO4)
.
(3)要检验步骤④中加入的稀硫酸是否足量的方法是
取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量(或若无气泡产生,则酸已足量)
取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量(或若无气泡产生,则酸已足量)
.
(4)若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量
>
>
(填“>”、“<”或“=”)原废液中硫酸锌的质量.要计算该废液中硫酸铜质量,必须要称量
固体D(或铜)
固体D(或铜)
的质量.