
题目列表(包括答案和解析)
解:设该纯碱样品中碳酸钠的质量为x,生成的氯化钠的质量为y,则( 0.5分 )
Na2CO3 +2 HCl = 2NaCl + H2O + CO2↑ (1分 )
106 117 44
x y 3.52g
![]()
![]()
x=8.48g ( 1 分 ) y=9.36g( 1 分 )
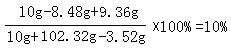 ( 1 分 )
( 1 分 )
纯碱(![]() )产品中常含有少量氯化钠。某厂生产的纯碱包装袋上标有“
)产品中常含有少量氯化钠。某厂生产的纯碱包装袋上标有“![]() 含量≥95%”字样。为判断该产品中
含量≥95%”字样。为判断该产品中![]() 的含量是否达到要求,称取5.0g样品进行检验,可供选取的装置如下图。其中,丙装置中装足量浓氢氧化钠溶液,丁装置中装浓硫酸,戊装置中装水。(提示:浓硫酸具有吸水性,不挥发,不与二氧化碳反应,碳酸钠受热不分解。)
的含量是否达到要求,称取5.0g样品进行检验,可供选取的装置如下图。其中,丙装置中装足量浓氢氧化钠溶液,丁装置中装浓硫酸,戊装置中装水。(提示:浓硫酸具有吸水性,不挥发,不与二氧化碳反应,碳酸钠受热不分解。)
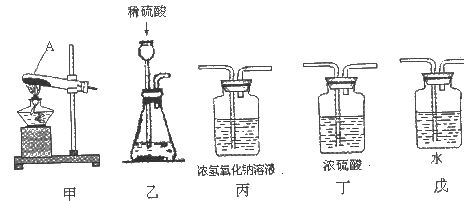
(1)写出上图仪器A的一种常见用途___________。
(2)你选择的实验装置从左到右组装排列为(填编号)___________。请说出你选择或排列装置的一点理由_________。
(3)假设每步都反应完全,生成的二氧化碳全部被吸收,不考虑空气中二氧化碳的影响。较准确地计算“![]() 含量≥95%”是否真实,该实验除称取样品质量外,还要用天平量得到的实验数据是 _________。
含量≥95%”是否真实,该实验除称取样品质量外,还要用天平量得到的实验数据是 _________。
(4)若乙装置中加入浓盐酸(有挥发性),对测量结果会产生影响。原因是浓盐酸挥发出的氯化氢气体__________。
(5)若实验装置连接正确,实验过程中看到丙装置出现的气泡比丁少得多,一种可能的原_____________。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com