
题目列表(包括答案和解析)
某同学欲配制符合下列条件的溶液,其中可能实现的是( )
A.只含0.1 mol Na+、0.2 mol Mg2+、0.1 mol Cl-和0.1 mol NO的溶液
B.只含0.1 mol NH4+、0.1 mol Ca2+、0.1 mol CO32—和0.1 mol Cl-的溶液
C.为了通过测定pH的大小,达到比较HCl和CH3COOH酸性强弱的目的,分别配制100 mL 0.1 mol/L的NaCl溶液和CH3COONa溶液
D.仅用1 000 mL的容量瓶、烧杯、玻璃棒、量筒、58.5 g NaCl固体和水配制1 L 1 mol/L的NaCl溶液
铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
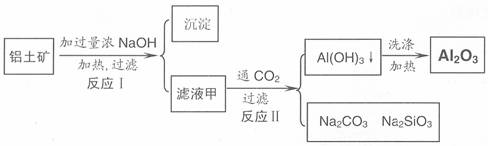
(1)滤液甲的主要成分是(写化学式)
(2)写出反应 II 的离子方程式:
(3)结合反应II,判断下列微粒结合质子(H+)的能力,由强到弱的顺序是
(填字母序号)
a.AlO2 或 [Al(OH)4]- b.OH c.SiO32
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为:
(5)取(4)电解以后的溶液 10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol• L-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解。
①加入50.0mL 盐酸溶液发生的离子反应的先后顺序依次为: 。
②请画出生成沉淀的物质的量与加入盐酸体积的关系图。
通过下列方法可以测定金属锡的纯度:
①将试样溶于盐酸中,发生的反应为:Sn+2HCl=SnCl2+H2↑
②加入过量的FeCl3溶液,发生的反应为:SnCl2+2FeCl3=SnCl4+2FeCl2
③用已知浓度的K2Cr2O7溶液滴定生成的Fe2+,发生的反应为:
6FeCl2+K2Cr2O7+14HCl=6FeCl3+2KCl+2CrCl3+7H2O
(1)上述氧化还原反应中,HCl作氧化剂的是________(填“①”、“②”或“③”).
(2)现有金属锡样品0.613 g,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液16.0 mL.求试样中锡的质量分数(假设杂质不参加反应).
某研究性学习小组欲用化学方法测定一个不规则容器的体积.把35.1 g NaCl放入500 mL的烧杯中,加入150 mL蒸馏水,待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释至完全充满容器;从中取出100 mL溶液,该溶液恰好与20 mL 0.100 mol/L AgNO3溶液完全反应.计算该容器的体积.
| |||||||||||||||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com