
题目列表(包括答案和解析)
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。
(1) 500℃、50MPa时,在容积为5L的密闭容器中加入4 mol N2、8 mol H2,反应达平衡时N2的转化率为25%,该反应的平衡常数为K,则K=__________________。
(2) 500℃、50MPa时,在容积为5L的密闭容器中,按下列配比作为起始物质,达到平衡后N2的转化率仍为25%的是_____________
A.2molN2+4molH2 B.2molN2+4molH2+ 6molHe
C.4molN2+8molH2+6molHe D.3molN2+5molH2+2molNH3
(3)希腊阿里斯多德大学的 George Marnellos 和 Michael Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式 。
(4)合成氨工厂常通过测定反应前后混合气体的密度来确定N2的转化率。某工厂测得反应前合成塔中N2和H2混合气体的密度为0.554g·L-1,从合成塔出来的混合气体在相同条件下密度为0.693g·L-1(密度均在标准状况下测定),则该合成氨厂N2的转化率_____________。
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。
(1) 500℃、50MPa时,在容积为5L的密闭容器中加入4 mol N2、8 mol H2,反应达平衡时N2的转化率为25%,该反应的平衡常数为K,则K=__________________。
(2) 500℃、50MPa时,在容积为5L的密闭容器中,按下列配比作为起始物质,达到平衡后N2的转化率仍为25%的是_____________
A.2molN2+4molH2 B.2molN2+4molH2+ 6molHe
C.4molN2+8molH2+6molHe D.3molN2+5molH2+2molNH3
(3)希腊阿里斯多德大学的 George Marnellos 和Michael Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式 。
(4)合成氨工厂常通过测定反应前后混合气体的密度来确定N2的转化率。某工厂测得反应前合成塔中N2和H2混合气体的密度为0.554g·L-1,从合成塔出来的混合气体在相同条件下密度为0.693g·L-1(密度均在标准状况下测定),则该合成氨厂N2的转化率_____________。
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。
(1) 500℃、50MPa时,在容积为5L的密闭容器中加入4 mol N2、8 mol H2,反应达平衡时N2的转化率为25%,该反应的平衡常数为K,则K=__________________。
(2) 500℃、50MPa时,在容积为5L的密闭容器中,按下列配比作为起始物质,达到平衡后N2的转化率仍为25%的是_____________
A.2molN2+4molH2 B.2molN2+4molH2+ 6molHe
C.4molN2+8molH2+6molHe D.3molN2+5molH2+2molNH3
(3)希腊阿里斯多德大学的 George Marnellos 和 Michael Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式 。
(4)合成氨工厂常通过测定反应前后混合气体的密度来确定N2的转化率。某工厂测得反应前合成塔中N2和H2混合气体的密度为0.554g·L-1,从合成塔出来的混合气体在相同条件下密度为0.693g·L-1(密度均在标准状况下测定),则该合成氨厂N2的转化率_____________。
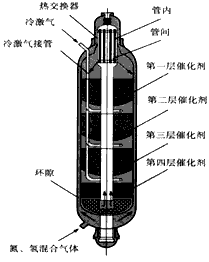
 2NH3(g) △H<0,下图是合成氨的简要流程示意图
2NH3(g) △H<0,下图是合成氨的简要流程示意图
 2NH3(g) △H<0,当压强为30MPa,温度为500℃时,在容积为1L的密闭容器中充入1molN2和3molH2,反应达到平衡时NH3的体积分数为20%,求此时的平衡常数________。
2NH3(g) △H<0,当压强为30MPa,温度为500℃时,在容积为1L的密闭容器中充入1molN2和3molH2,反应达到平衡时NH3的体积分数为20%,求此时的平衡常数________。 2NH3(g)
2NH3(g)  CO2(g) +H2(g) △H>0。
CO2(g) +H2(g) △H>0。 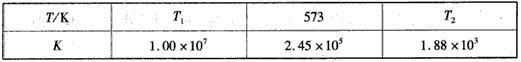
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com