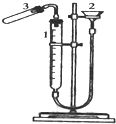
利用右图装置测定金属镁的相对原子质量.请根据要求回答有关问题:(所提供试剂有:0.48克镁带、18.4mol?L
-1的H
2SO
4、2.0mol?L
-1的H
2SO
4)
实验方法如下:
(1)加药品前要检查该装置的气密性,较简便单的方法是:
向漏斗中加入一定量的水,若量气管内水面低于漏斗中的水面,且数分钟(或一段时间)保持不变,则气密性良好
向漏斗中加入一定量的水,若量气管内水面低于漏斗中的水面,且数分钟(或一段时间)保持不变,则气密性良好
.
(2)气密性检验后,按以下步骤进行实验,请回答有关问题:
①装硫酸.取下试管,加入
2.0mol?L-1
2.0mol?L-1
mol/L的H
2SO
4且体积应大于
10
10
ml.
②放置镁条.为保证产生的氢气不泄漏,应将镁条放置在
试管口的上部,不与硫酸接触
试管口的上部,不与硫酸接触
.
③记下量气管起始读数V
1. ④将试管竖直,使镁条滑到试管中与酸反应;
⑤记下镁条反应完后的量气管读数V
2.如何读数才能减少误差
待试管冷却至室温,调节漏斗高度,使两端管内液面保持相平
待试管冷却至室温,调节漏斗高度,使两端管内液面保持相平
.
(3)经测定镁与酸反应产生H
2的体积为V L(已折算成标准状况),则镁的相对原子质量的表达式为(相对原子质量用M表示):.
(4)如果测得的值比实际值偏大,请你分析产生误差偏大的可能原因(假设在测得外界温度、压强以及在换算、计算过程中都没有错误.至少写2条)①②.

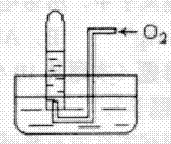 A.49mL B.30mL
A.49mL B.30mL

 利用右图装置测定金属镁的相对原子质量.请根据要求回答有关问题:(所提供试剂有:0.48克镁带、18.4mol?L-1的H2SO4、2.0mol?L-1的H2SO4)
利用右图装置测定金属镁的相对原子质量.请根据要求回答有关问题:(所提供试剂有:0.48克镁带、18.4mol?L-1的H2SO4、2.0mol?L-1的H2SO4)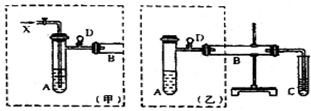 实验室可利用乙醇、铜或铜的化合物制备乙醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出).试回答:
实验室可利用乙醇、铜或铜的化合物制备乙醛,右图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出).试回答: