
题目列表(包括答案和解析)
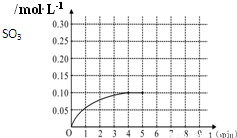
 一定温度下,将0.4molSO2和0.2molO2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图:
一定温度下,将0.4molSO2和0.2molO2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图:(15分) 为省药品和时间,甲、乙、丙三位同学用铜片、锌片、铁片、稀H2SO4、NaCl溶液、ZnSO4溶液、CuSO4溶液;石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),以巧妙的构思,“接力”的方式,利用不同原理分别设计了比较铜与锌金属活动性相对强弱的系列实验。试填写下列空白:
⑴甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),小心向烧杯中加入稀硫酸,观察到的现象是 。甲同学的设计思路是 。
⑵乙同学接着甲的实验,向烧杯中滴加 溶液,进而观察到的现象是 , 。乙同学作出锌、铜金属活动性相对强弱所依据的原理是 , 。
⑶丙同学认为在锌的表面镀铜可以有效防止锌的锈蚀,但如果镀铜层破损后,在潮湿的空气中反而加速锌的锈蚀,原因是在锌的表面构成了无数微小的原电池。试写出有关电极反应式:负极 ;正极 。
⑷请你利用题给药品与仪器,区别于甲、乙的设计原理,再设计一个简单的实验,证实锌和铜的金属活动性的相对强弱(简要说明操作和现象) 。
 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点/℃ | 20.8 | 117.9 | 290 | 197.2 | 100 |
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
|
物质 |
乙醛 |
乙酸 |
甘油 |
乙二醇 |
水 |
|
沸点 |
20. 8℃ |
117.9℃ |
290℃ |
197.2℃ |
100℃ |

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件)____________________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在_____________;目的是____________________;当试管A内的主要反应完成后温度计水银球的位置应在___ _________,目的是_______________________;
(3)烧杯B的作用是___________________________;烧杯B内盛装的液体可以是____________(写出一种即可,在题给物质中找);
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com