
题目列表(包括答案和解析)
| 元素 | A | B | C | D |
| 有关性质或结构信息 | 能形成+7价的化合物 | 基态原子核外s能级上的电子数是p能级上的电子数的2倍 | 该元素形成的单质通常有两种同素异形体,其中一种单质分布在高空,起着阻止紫外辐射的作用 | 通常情况下能形成短周期中最稳定的双原分子分子 |
| Li | Be | B | C | O | F |
电负性 | 0.98 | 1.57 | 2.04 | 2.53 | 3.44 | 3.98 |
| Na | Al | Si | P | S | Cl |
电负性 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)若Mg、N的电负性分别表示为X?(Mg)、X?(N),则X(Mg)、X(N)的各自范围是:
_________<X(Mg)< _________,_________<X(N)< _________。
(2)电负性与原子半径的关系是____________________________;短周期元素的电负性的变化特点,体现了元素性质的_________变化规律。
(3)某有机物中含有S—N键,你认为共用电子对偏向_________原子。
(4)经验规律告诉我们,当成键的两原子相对应的元素的电负性差值大于1.7时,一般为离子键,当电负性差值小于1.7时,一般为共价键。由此可推测AlBr3中化学键的类型是_________。
(10分)短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外第三层电子数目比第一层多1个,C―比A元素的离子多1个电子层,D元素的原子核外第二层比第一层多2个电子。回答下列问题:
(1)A元素的名称是_______;
(2)C―的结构示意图为 ;D元素在周期表中的位置是__________;
(3)元素D的气态氢化物的电子式为____,其分子的结构特点是具有_____结构,在一定条件下该氢化物可与单质C发生取代反应,若将等物质的量的该氢化物与单质C混合,在一定条件下充分反应后,生成物中物质的量最大的是_______(用化学式填写);
(4)工业上冶炼单质A的化学方程式为_____________________________________;
(5)工业上常用单质B冶炼难熔的金属,写出氧化铁和单质B在高温下反应的化学方程式_______,若反应中有0.25mol氧化铁参加反应反应中转移电子的个数为__________;
(6)若将单质A、B用导线连接插入到氢氧化钠溶液中可以组成原电池,则正极材
料是_______(用化学式填写),负极电极反应是___________________________________。
短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
| X | Y | Z |
W |
|
|
|
(1)X元素在元素周期表中的位置___? __________。
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为_______________。
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为????????????????????????????? _。
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器____(填“能”或“不能”)用来腌制咸菜,原因是_________________________________________。
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式___________。

关于该电池的下列说法,正确的是______
A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性,能被酸性KMnO4氧化,请填写相应的离子,并给予配平: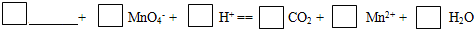 。
。
(10分) 短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外第三层电子数目比第一层多1个,C―比A元素的离子多1个电子层,D元素的原子核外第二层比第一层多2个电子。回答下列问题:
(1)A元素的名称是_______;
(2)C―的结构示意图为 ;D元素在周期表中的位置是__________;
(3)元素D的气态氢化物的电子式为____,其分子的结构特点是具有_____结构,在一定条件下该氢化物可与单质C发生取代反应,若将等物质的量的该氢化物与单质C混合,在一定条件下充分反应后,生成物中物质的量最大的是_______(用化学式填写);
(4)工业上冶炼单质A的化学方程式为_____________________________________;
(5)工业上常用单质B冶炼难熔的金属,写出氧化铁和单质B在高温下反应的化学方程式_______,若反应中有0.25mol氧化铁参加反应反应中转移电子的个数为__________;
(6)若将单质A、B用导线连接插入到氢氧化钠溶液中可以组成原电池,则正极材
料是_______(用化学式填写),负极电极反应是___________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com