
题目列表(包括答案和解析)
| c(H2)c(CO) |
| c(H2O) |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式(15分) 某研究性学习小组为确定某碱式碳酸镁样品的组成,设计出了下图所示的实验装置(图中A至D的部分)。[已知碱式碳酸镁Mgx(OH)y(CO3)z(x、y、z为正整数)加热能分解生成氧化镁、水和二氧化碳]

(1)按上图(夹持仪器未画出)组装好实验装置后,应首先进行的操作是_____________;A处干燥管盛放的药品是_____________,其作用是____________________________。
(2)指导老师在审阅设计方案后指出需要在E处进行改进,请你帮助该小组设计出改进方案:____________________________________。
(3)加热前需要进行的必要操作是__________________________________,其目的是____________________________________;对活塞的操作方法是:关闭活塞 ________,打开活塞________。
(4)通过什么现象能够说明碱式碳酸镁分解完全____________________________。
(5)待B装置中的反应完全后,打开K1,再缓缓鼓入空气数分钟,其目的是________________________。
(6)实验测得数据如下:碱式碳酸镁样品22.6 g;反应前C装置的质量为87.6 g,反应后质量为89.4 g;反应前D装置的质量为74.7 g,反应后质量为83.5 g。请计算推导该碱式碳酸镁的化学式___________________________,该碱式碳酸镁受热分解的化学方程式为 。
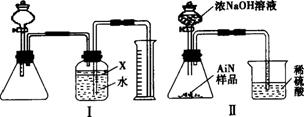
(1)实验有关操作为:a.往锥形瓶中放入适量的AlN样品;b.从分液漏斗往锥形瓶中加入过量的浓NaOH;c.检查装置的气密性;d.测定收集到水的体积。正确的操作顺序为_____________。
(2)本试验中检查装置气密性的方法是______________。
(3)广口瓶中的试剂X可选用___________(填选项序号)。
A.汽油 B.酒精 C.植物油 D.四氯化碳
(4)广口瓶的液体没有装满(上方留有少量空间),实验测得NH3的体积将____________(填“偏大”“偏小”或“不变”)。
(5)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是__________________。
(6)若实验中测得样品的质量为w g,氨气的体积为a L(标准状况),则样品中AlN的质量分数为_______________(AlN的相对分子质量为41)。
(7)有人改用图Ⅱ装置进行同样的实验,通过测定烧杯中硫酸的增重来确定样品中AlN的质量分数。你认为是否可行____________(填“可行”或“不可行”),原因是_________________,改进的方法是___________________________________________________________________。
(15分)某化学小组为测定加碘盐中KIO3的质是分数并制备少量KIO3,进行了如下实验。
I .测定加碘盐中KIO3的质量分数(杂质不发生反应)
已知:
步骤一:准确称取a g加碘盐,配制成250 mL溶液;
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:以淀粉为指示剂,用c mol.L-1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据。重复滴定2次,平均消耗Na2S2Or溶液12.00 mL。
(1) 步骤一中配制250mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有____________
(2) 步骤三中到达滴定终点时的现象为____________
(3) 实验测得此加碘盐中KIO3的质量分数=______ ______ (KIO3的相对分子质量为214)。
II.实验室制备KIO3
已知:碘酸盐可以用氯气在碱性溶液中氧化碘化物得到。
该化学小组通过以下装置制备KIO3
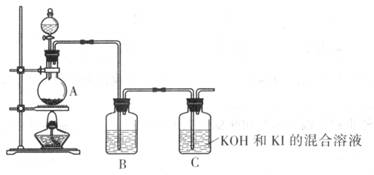
(4) 装置A中反应的离子方程式为____________
(5) 装置B中的试剂为____________
(6) 写出装置C中生成KIO3的离子方程式____________。
(7) 上述实验装置存在一处明显缺陷,请指出: __________________。
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域。某氮化铝中含有碳或氧化铝杂质,现用图Ⅰ装置来进行实验,使氮化铝样品和NaOH溶液反应:AlN+NaOH+H2O====NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计)。
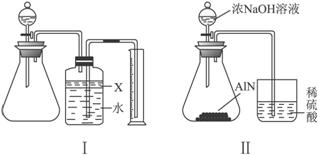
(1)实验有关操作为:
A.往锥形瓶中放入适量的AlN样品 b.从分液漏斗往锥形瓶中加入过量的浓NaOH
c.检验装置的气密性 d.测定收集到水的体积
正确的操作顺序为___________________________。
(2)本实验中检查装置气密性的方法是__________________。
(3)广口瓶中的试剂X应选用_________(填选项的编号)。
A.汽油 B.酒精 C.植物油 D.CCl4
(4)广口瓶内的液体没有装满(上方留有少量空间),实验测得NH3的体积将_________(填“偏大”“偏小”或“不变”)。
(5)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是_________。
(6)若实验中测得样品的质量为wg,氨气的体积为a L(标况下),则样品中AlN的质量分数为_________(AlN的式量为41)。
(7)有人改用图Ⅱ装置进行同样实验,通过测定烧杯中硫酸的增重来确定样品中A1N的质量分数。你认为是否可行?_________(填“可行”或“不可行”)。原因是_________,改进的方法为_________(若认为“可行”,此空格不需回答)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com