氨气是一种重要的基础化工原料,用途广泛.
在微电子工业中,氨水可作刻蚀剂H
2O
2 的清除剂,产物不污染环境.该反应的化学方程式为2NH
3+3H
2O
2═
N2
N2
+6H
2O
工业中常用以下反应合成氨:N
2+3H
2?2NH
3△H<0.某实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N
2)=0.100mol/L,c(H
2)=0.300mol/L进行反应时,N
2的浓度随时间的变化如下图①、②、③曲线所示.
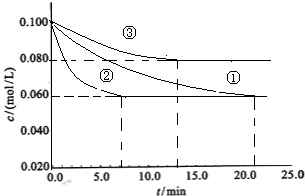
(1)该反应平衡常数的数学表达式
;实验②平衡时H
2的转化率为
40%
40%
(2)据图所示,②、③两装置中各有一个条件与①不同.请指出,并说明判断的理由.
②条件:
加了催化剂
加了催化剂
理由:
因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动所以①②两装置达到平衡时N2的浓度相同.
因为加入催化剂能缩短达到平衡的时间,但化学平衡不移动所以①②两装置达到平衡时N2的浓度相同.
③条件:
温度升高
温度升高
理由:
该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①
该反应为放热反应,温度升高,达到平衡的时间缩短,但平衡向逆反应方向移动,③中到达平衡时N2的浓度高于①
.

 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4?2NO2的平衡.如图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4  2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡.下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)