
题目列表(包括答案和解析)
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入______________。
(2)除去蒸馏水中溶解的O2常采用________________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_______________________________________。

方法二:在如上图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是______________________。
(2)在试管Ⅱ里加入的试剂是______________________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是____________________________________________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是____________________________。
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________________________。
(2)除去蒸馏水中溶解的O2常采用__________________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是______________________________。
方法二:在图6-10中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。

图6-10
(1)在试管Ⅰ里加入的试剂是_______________________________。
(2)在试管Ⅱ里加入的试剂是_________________________________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是__________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是________________________。
用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________________。
(2)除去蒸馏水中溶解的O2常采用的方法是_______________________________________。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是___________________________________________。
方法二:在如下图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。

(1)在试管Ⅰ里加入的试剂是___________________。
(2)在试管Ⅱ里加入的试剂是___________________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是____________________________________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是________________________________________________________。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还加入___________________________________。
(2)除去蒸馏水中溶解的O2常采用______________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是______________________________________。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。

(1)在试管Ⅰ里加入的试剂是____________________________________。
(2)在试管Ⅱ里加入的试剂是____________________________________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是___________________________________________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_________________________。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。?
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。?
(2)除去蒸馏水中溶解的O2常采用 的方法。?
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。?
方法二:在如图11-1装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
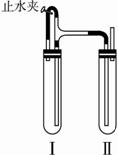
图11-1
?
(1)在试管Ⅰ里加入的试剂是 。?
(2)在试管Ⅱ里加入的试剂是 。?
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。?
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com