(2013?河西区一模)铝镁合金是轮船制造、化工生产等行业的重要材料.为测定某铝镁合金(不含其它元素)中镁的质量分数,某实验小组设计了下列实验方案,每个方案均称取5.4g粉末状样品进行探究.请按要求回答下列问题:
[实验l]铝镁合金
测定剩余固体质量.
已知:试剂X焰色反应为黄色.
(1)将称量好的样品放入V
1mL 2.0mol/L试剂X中,充分反应.此反应的离子方程式为
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
;V
1的取值范围是
≥100mL
≥100mL
mL.
(2)经过滤、干燥、称量固体,测得镁的质量分数
偏高
偏高
(填“偏高”或“无影响”或“偏低”),其原因是
过滤后没有洗涤
过滤后没有洗涤
.
[实验2]铝镁合金
测定数据
(l)欲计算镁的质量分数,该实验还需测定的数据是
灼烧后固体的质量
灼烧后固体的质量
.
(2)若用空气代替O
2进行实验,则测定镁的质量分数将
偏高
偏高
填“偏高”或“无影响”或“偏低”).[已知:3Mg+N
2Mg
3N
2]
[实验3]铝镁合金
测定生成无色气体的体积
实验装置如下图:
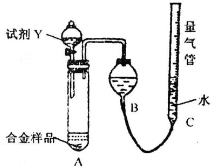
(1)该实验在盛装药品之前应首先进行的实验步骤是
检查装置的气密性
检查装置的气密性
.
(2)同学甲选定试剂Y进行实验,当发现装置A中样品迅速溶解完全后,立即调整量气管C中液面与B中液面相平,测得产生气体体积为V
2L[已折算为标准状况下,A中液体体积忽略不计,下述(3)中同].试剂Y的名称是
稀盐酸或稀硫酸
稀盐酸或稀硫酸
.所测镁的质量分数偏低的理由是
放热反应,温度升高,测定的氢气的体积偏大,又Al的含量越大,生成氢气越多,则氢气的体积大时计算出Mg的质量分数偏低
放热反应,温度升高,测定的氢气的体积偏大,又Al的含量越大,生成氢气越多,则氢气的体积大时计算出Mg的质量分数偏低
.
(3)同学乙将试剂Y换为实验1中的试剂X,假设操作均正确,充分反应后测得产生气体体积为V
3L,则镁的质量分数为
(含V
3的表达式).




