2012年1月,广西河池龙江河段检测出重金属镉离子(Cd
2+)含量超标,当地政府积极展开治污工作.聚合氯化铝可以将离子状态的镉固化,这是当前可采取治理镉污染的最有效方法.
已知:①煤矸石是煤矿在洗煤和选煤过程中大量排出的固体废弃物,煤矸石主要含Al
2O
3、SiO
2及铁的氧化物.
②聚合氯化铝([Al
2(OH)
nCl
6-n]
m(1≤n≤5,m≤10),商业代号PAC)是一种新型、高效絮凝剂和净水剂.
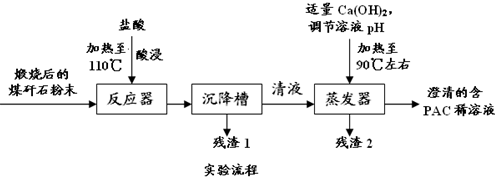
以煤矸石为原料,采用铝盐水解絮凝法,制得聚合氯化铝的工艺流程如图1:
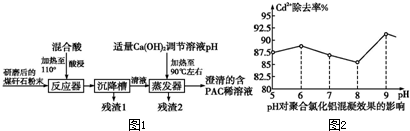
回答下列相关问题:
(1)向反应器中加入混合液(20%的硫酸和盐酸)酸浸,其目的是
.
(2)流程中残渣1可用于工业上制取粗硅,写出该反应的化学方程式
.
(3)流程中残渣2的主要成分是
,确认该成分中阳离子的方法是
.
(4)聚合氯化铝除镉的原理是生成了氢氧化铝胶体吸附镉离子,确定已生成氢氧化铝胶体的方法可利用胶体性质中的
.
(5)常温下以溶液pH为横坐标,Cd
2+的除去率为纵坐标,实验结果如图所示,由图2可知,Cd
2+的除去率最高时,溶液的c(OH
-)=
.


 ④
④