
题目列表(包括答案和解析)
 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.| 11 |
| 3 |
| 11 |
| 3 |
下图两个装置中用滴有酚酞的NaCl溶液做电解质溶液,进行化学能和电能相互转化的研究。请回答:
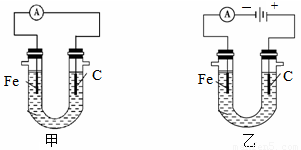
(1)写出两个铁电极上的电极反应式。
甲:
乙:
(2)甲装置中 电极附近的溶液先变红,乙装置中 电极附近的溶液先变红。
(3)检验乙中C电极反应产物的方法是 。
(4)电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式: 。所得消毒液中离子浓度的由大到小顺序 。
(5)如果起始时乙中盛有足量一定浓度的CuSO4溶液,反应一段时间后,要使溶液恢复到以前的状态,可向溶液中加入一定量的 (填化学式)。
2CNO-+3ClO-+2 H+====N2↑+2CO2↑+3Cl-+H2O。某科研部门用图1-5-25所示装置进行模拟实验,以证明上述处理CN-污水方法的有效性,并测定CN-被处理的百分率,下述实验装置通过测定CO2的量来确定CN-的处理效果。
试根据要求完成下列问题:
(1)将浓缩后含CN-的污水(其中CN-浓度为0.50 mol·L-1)20 mL倒入甲装置中,再向甲装置中加入过量的漂白粉溶液,塞上橡皮塞,一段时间后,打开活塞,使溶液全部进入乙中,关闭活塞。乙装置中生成的气体除含有CO2、N2、HCl外,还有副反应生成的Cl2等物质,写出生成Cl2的副反应的离子方程式:_____________________________________________。
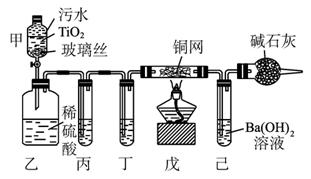
图1-5-25
(2)丙中加入的除杂试剂是_________,丁中的试剂是_________。
A.饱和碳酸氢钠溶液 B.饱和食盐水
C.浓硫酸 D.饱和碳酸钠溶液
(3)戊在实验中的作用是______________________________________________________
____________________________________________________________________。
(4)若己中盛有足量氢氧化钡,实验后己中共生成1.773 g沉淀,则该实验中CN-被处理的百分率为_________ (Ba的相对原子质量为137)。
(5)若己中盛有的氢氧化钡溶液为10 mL,要使CN-完全被氧化,氢氧化钡的物质的量浓度最低为_________ (保留1位小数)。
(6)上述实验中造成戊中碳酸钡质量测定值偏小的可能原因有(写出两点即可) ____________
_____________________________________________________________________。
环境保护是我国的一项基本国策。含CN-的污水毒性和危害极大。治理含CN-污水的方法之一是:在催化剂TiO2作用下,用NaClO将CN-氧化成CNO-,CNO-在酸性条件下继续被NaClO氧化成CO2、N2和H2O。其离子反应方程式为:2CN-+5ClO-+2H+===2CO2↑+N2↑+5Cl-+H2O,试根据要求回答下列问题:
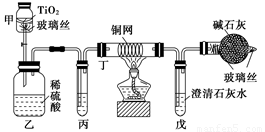
(1)将浓缩后含CN-的污水(其中CN-浓度为0.05 mol/L)200 mL倒入甲装置中,再向甲装置中加入过量的漂白粉溶液,塞上橡皮塞,一段时间后,打开活塞,使溶液全部进入乙中,关闭活塞。
①乙装置中生成的气体除含有CO2、N2、HCl外还有副反应生成的Cl2等,写出生成Cl2的副反应的离子方程式: _______________________________________。
②丙中加入的除杂试剂是________(填字母代号)。
A.饱和食盐水 B.饱和碳酸氢钠溶液
C.浓NaOH溶液 D.浓硫酸
③丁在实验中的作用是_______________________________________________________。
④戊中盛有足量石灰水,若实验后戊中共生成0.8 g沉淀,则该实验中CN-被处理的百分率________(填“>”、“=”或“<”)80%。(不考虑CO2的溶解)
(2)上述实验中造成戊中碳酸钙质量测定值偏小的可能原因有(写出两点即可):________________________________________________________________________。
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答。
(1)甲组同学采用如图所示装置验证铜与硝酸的反应。已知仪器a中盛有足量一定浓度的硝酸溶液,试管b中盛有3.2 g铜。

①请写出铜与稀硝酸反应的离子反应方程式 。
②在铜与硝酸的反应中,硝酸所表现出的化学性质主要有 。
③仪器c中收集的气体主要是 。(填分子式)
④待试管b中反应进行完全,如果向b中液体里加入足量氢氧化钠溶液,可生成沉淀的质量是 g。
(2)乙组同学对铁与稀硝酸的反应进行探究。他们用a mol Fe和含有b mol HNO3的稀硝酸进行实验,若两种物质恰好反应都无剩余,且HNO3只被还原成NO,反应结束后溶液中含有Fe3+和Fe2+。则
①反应结束后的溶液中NO3-的物质的量的取值范围是 。(用含a的代数式等表示)
②若反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+)∶n(Fe2+) 为3∶1,则b/a的值为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com