
题目列表(包括答案和解析)
(10分)
Ⅰ醇脱水反应在不同温度条件下得到的产物组成不同。下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同。
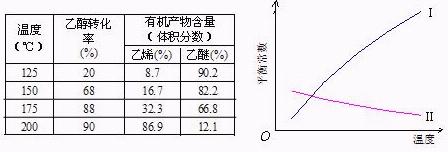 |
![]()
已知:乙醇和乙醚(CH3CH2OCH2CH3)的沸点分别为78.4℃和34.5℃。试分析:
(1)乙醇脱水制乙烯的反应是 (填“放热”、“吸热”)反应,若增大压强,平衡
(选填 “正向”、“逆向”、“不”)移动。
(2)写出乙醇脱水制乙醚的反应的平衡常数表达式K= 。
当乙醇起始浓度相同时,平衡常数K值越大,表明 (填序号)。
a.乙醇的转化率越高 b.反应进行得越完全
c.达到平衡时乙醇的浓度越大 d.化学反应速率越快
(3)根据表中数据分析,150℃时乙醇催化脱水制取的乙醚产量 (选填“大于”、“小于”、“等于”)125℃时;为了又快又多地得到产品,乙醇制乙醚合适的反应温度区域是 。
Ⅱ水垢中含有的CaSO4,先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3 ,而后用酸去除。从CaSO4到CaCO3的沉淀转化中,并存在着两个沉淀溶解平衡,
写出前一个沉淀溶解平衡表达式:
已知Ksp(CaCO3) =2.8×10-9 mol2/L2 ,将136gCaSO4固体加入1L Na2CO3溶液中,待沉淀转化后,溶液中c(CO32-) = 0.001mol/L。计算Ksp(CaSO4) = mol2/L2
(忽略溶液体积变化)
15
Ⅰ醇脱水反应在不同温度条件下得到的产物组成不同。下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同。
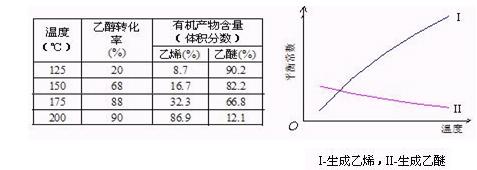
已知:乙醇和乙醚(CH3CH2OCH2CH3)的沸点分别为78.4℃和34.5℃。试分析:
(1)乙醇脱水制乙烯的反应是 (填“放热”、“吸热”)反应,若增大压强,平衡 (选填 “正向”、“逆向”、“不”)移动。
(2)写出乙醇脱水制乙醚的反应的平衡常数表达式K= 。
当乙醇起始浓度相同时,平衡常数K值越大,表明 (填序号)。
a.乙醇的转化率越高 b.反应进行得越完全
c.达到平衡时乙醇的浓度越大 d.化学反应速率越快
(3)根据表中数据分析,150℃时乙醇催化脱水制取的乙醚产量 (选填“大于”、“小于”、“等于”)125℃时;为了又快又多地得到产品,乙醇制乙醚合适的反应温度区域是 。
Ⅱ水垢中含有的CaSO4,先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3 ,而后用酸去除。从CaSO4到CaCO3的沉淀转化中,并存在着两个沉淀溶解平衡,
写出前一个沉淀溶解平衡表达式:
已知Ksp(CaCO3) =2.8×10-9 mol2/L2 ,将136gCaSO4固体加入1L Na2CO3溶液中,待沉淀转化后,溶液中c(CO32-) = 0.001mol/L。计算Ksp(CaSO4) = mol2/L2
(忽略溶液体积变化)
| |||||||||||
(08松江区模拟)一定温度下,在体积为V L的密闭容器中,发生某可逆反应,其化学平衡常数表达式为:K=![]() 。
。
(1)写出该反应的化学方程式 ;
(2)若第t1 秒时,CO的物质的量为n mol,到第t2 秒时恰好达到平衡,此时CO的物质的量浓度为m mol/L,这段时间内的化学反应速率v(CO) = mol/L?s;
(3)向该平衡体系中通入一定量的H2,则平衡向 反应方向移动,平衡常数K
(填“增大”、“减小”或“不变”);
(4) 该反应的逆反应速率随时间变化的关系如图。
该反应的逆反应速率随时间变化的关系如图。
① 从图中看到,反应进行至t1时________ (填序号)
a.v(正)> v(逆) b.v(正) = v(逆) c.v(正) < v(逆)
② t1时改变了某种反应条件,改变的条件不可能
是_________(填序号)。
a.减小H2浓度 b.增大CO浓度 c.使用催化剂
| c(CH3COO-)?c(H+) | c(CH3COOH) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com