
题目列表(包括答案和解析)
某厂以甘蔗为原料制糖;对产生的大量甘蔗渣按如下图所示的转化进行综合利用。其中B是A水解的最终产物;C的化学式为C3H6O3,一定条件下2个C分子间脱去2个水分子可生成一种六元环状化合物;D可使溴水褪色;H的三聚合物I也是一种六元环状化合物(图中部分反应条件及产物没有列出)。

(1)写出下列物质的结构简式:高分子化合物F ;六元环状化合物I 。
(2)C→D的反应类型为 。D→E的反应类型为 。
(3)写出下列反应的化学方程式:
A→B 。
C→可降解塑料 。
(4)H分子所含官能团的名称是 ,实验室中常用于检验该官能团的试剂的名称是(只写一种) 。
(5)G转变成CH4的反应曾做过如下的同位素示踪实验(D、T为H的同位素):
![]()
![]()
在同样条件下,完成下列反应:![]()
2I-+2Fe3+ƒ2Fe2++I2(aq)
(1)该反应的平衡常数K的表达式为:K=________,当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡________移动(填“向右”、“向左”或“不”)。
(2)上述反应的正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)×cn(Fe3+)(k为常数)
浓度与反应速率的关系
c(I-)/mol×L-1 c(Fe3+)/mol×L-1 v/
mol×L-1
(1) 0.20 0.80 0.032k
(2) 0.60 0.40 0.144k
(3) 0.80 0.20 0.128k
通过所给的数据计算可知:
在v=kcm(I-)×cn(Fe3+)中,m、n的值为( )
A.m=1,n=1 B.m=1,n=2
C.m=2,n=1 D.m=2,n=2
I-浓度对反应速率的影响________Fe3+浓度对反应速率的影响(填“大于”、“小于”或“等于”)。
对于反应aA+bBƒcC+dD,反应达到平衡时,K=c(C)c×c(D)d/c(A)a×c(B)b(K为平衡常数),Fe3+和I-在水溶液中的反应如下:
2I-+2Fe3+ƒ2Fe2++I2(aq)
(1)该反应的平衡常数K的表达式为:K=________,当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡________移动(填“向右”、“向左”或“不”)。
(2)上述反应的正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)×cn(Fe3+)(k为常数)
浓度与反应速率的关系
c(I-)/mol×L-1 c(Fe3+)/mol×L-1 v/ mol×L-1×s-1
(1) 0.20 0.80 0.032k
(2) 0.60 0.40 0.144k
(3) 0.80 0.20 0.128k
通过所给的数据计算可知:
在v=kcm(I-)×cn(Fe3+)中,m、n的值为( )
A.m=1,n=1 B.m=1,n=2
C.m=2,n=1 D.m=2,n=2
I-浓度对反应速率的影响________Fe3+浓度对反应速率的影响(填“大于”、“小于”或“等于”)。
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
(1)I、II、III、IV装置可盛放的试剂是I ;II ;III ;IV (填序号)。
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是 。
(3)使用装置II的目的是 。
(4)使用装置III的目的是 。
(5)确定含有乙烯的现象是 。

I、二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl更好。
⑴ 在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是 。
⑵ 用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。
饮用水中的ClO2、ClO2—含量可用连续碘量法进行测定。ClO2被I—还原为ClO2—、Cl—的转化
率与溶液pH的关系如下图所示。当pH≤2 .0时,ClO2—也能被I—完全还原为Cl—。反应生成
的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
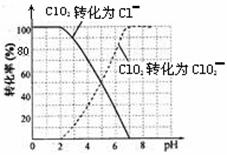 ①请写出pH≤2 .0时ClO2—与I—反应的离子方程式 。
①请写出pH≤2 .0时ClO2—与I—反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4: 加入少量淀粉溶液,用c mol·L-1Na2S2O3
溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水中ClO2—的浓度为 mol·L-1(用含字母的代数式表示)。
II.(11分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:

⑴ 在农业生产中,滤液1可用作 。
⑵ 流程中生成高铁酸钾的离子方程式是: ,控制此反应温度30℃以下的原因是: 。
⑶结晶过程中加入浓KOH溶液的作用是: 。
⑷某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是2:3,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 。
⑸实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在 附近、反应时间应控制在 。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com