
题目列表(包括答案和解析)
大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染.对燃煤废气进行脱硝、脱硫和脱碳等处理,可实现绿色环保、节能减排、废物利用等目的.
(1)下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的有________(填字母).
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)脱硝.利用甲烷催化还原NOx:
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g+2H2O(g) ΔH2=-1160 kJ·mol-1
2N2(g)+CO2(g+2H2O(g) ΔH2=-1160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为________.
(3)脱碳.将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
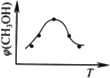
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数![]() (CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应的ΔH3________0(填“>”、“<”或“=”).
(CH3OH)与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应的ΔH3________0(填“>”、“<”或“=”).
②在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如下图所示.下列说法正确的是________(填字母代号).

A.第10 min后,向该容器中再充入1 mol CO2和3 mol H2,则再次达到平衡时C(CH3OH)=1.5 mol/L
B.0~10 min内,氢气的平均反应速率为0.075 mol/(L·min)
C.达到平衡时,氢气的转化率为75%
D.该温度下,反应的平衡常数的值为3/16
E.升高温度将使n(CH3OH)/n(CO2)减小
③有学者设想以下图所示装置用电化学原理将CO2转化为重要化工原料.若A为CO2,B为H2,C为CH3OH,则正极电极反应式为________.

(4)脱硫.某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥.硫酸铵和硝酸铵的水溶液的pH<7,其中原因可用一个离子方程式表示为:________;在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中[Na+]+[H+]________[NO3-]+[OH-](填写“>”“=”或“<”)
为测定![]() 在水中的溶解度,进行下述实验:
在水中的溶解度,进行下述实验:
(1)取一干燥的球形容器,称它的质量为1.932克;
(2)在此球形容器中注少量水,将![]() 通入此盛水的球形容器中直到溶液饱和(1.013×
通入此盛水的球形容器中直到溶液饱和(1.013×![]() 帕和15℃时),称球形容器和饱和溶液共重3.877克;
帕和15℃时),称球形容器和饱和溶液共重3.877克;
(3)把此球形容器放入50毫升0.500 mol·![]() 硫酸溶液中,将此球形容器击破;
硫酸溶液中,将此球形容器击破;
(4)剩余的硫酸再用0.500 mol·![]() 的氢氧化钠溶液做中和滴定,消耗了NaOH溶液16.4毫升.
的氢氧化钠溶液做中和滴定,消耗了NaOH溶液16.4毫升.
试计算在1.013×![]() 帕和15℃时该氨水的密度是0.878 g·
帕和15℃时该氨水的密度是0.878 g·![]() ,求它的物质的量浓度.
,求它的物质的量浓度.
(1)取一干燥的球形容器,称它的质量为1.932克;
(2)在此球形容器中注少量水,将![]() 通入此盛水的球形容器中直到溶液饱和(1.013×
通入此盛水的球形容器中直到溶液饱和(1.013×![]() 帕和15℃时),称球形容器和饱和溶液共重3.877克;
帕和15℃时),称球形容器和饱和溶液共重3.877克;
(3)把此球形容器放入50毫升0.500 mol·![]() 硫酸溶液中,将此球形容器击破;
硫酸溶液中,将此球形容器击破;
(4)剩余的硫酸再用0.500 mol·![]() 的氢氧化钠溶液做中和滴定,消耗了NaOH溶液16.4毫升.
的氢氧化钠溶液做中和滴定,消耗了NaOH溶液16.4毫升.
试计算在1.013×![]() 帕和15℃时该氨水的密度是0.878 g·
帕和15℃时该氨水的密度是0.878 g·![]() ,求它的物质的量浓度.
,求它的物质的量浓度.
(18分)某学生欲用已知物质的量浓度的氨水来测定未知物质的量浓度的盐酸溶液,请填写下列空白:
Ⅰ.(1)(6分)用标准的氨水溶液滴定盐酸溶液时,锥形瓶中应加入 作指示剂, ___ ____手摇动锥形瓶,眼睛注视 ,滴定终点现象为:
(2)下列操作中可能使所测盐酸溶液的浓度数值偏低的是___ (2分)
A.酸式滴定管未用盐酸溶液润洗就直接注入盐酸溶液
B.滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管尖嘴处在滴定前有气泡,滴定后气泡消失
D.读取氨水体积时,滴定开始时仰视读数,滴定结束时俯视读数
E. 滴定时标准液滴出锥形瓶外
Ⅱ. (10分)常温下,用0.2 mol·L-1氨水溶液滴定20ml盐酸溶液,随氨水滴加溶液PH变化如图所示,据图回答下列问题:
(1)该盐酸溶液的物质的量浓度为 。
(2)在c点溶液中所有离子浓度由大到小的顺序为:
(3)若正确加入指示剂,滴定终点位于曲线
A.d点 B.c点 C.a、c之间 D.d点之后
(4) a、b、c三点处溶液中,水电离出的氢离子浓度由大到小顺序为 。
(用a、b、c表示)
(5)写出d点溶液中c(NH3·H2O)的精确表达式
mol·L-1 (混合溶液总体积等于两溶液体积之和)
(18分)某学生欲用已知物质的量浓度的氨水来测定未知物质的量浓度的盐酸溶液,请填写下列空白:
Ⅰ.(1)(6分)用标准的氨水溶液滴定盐酸溶液时,锥形瓶中应加入 作指示剂, ___ ____手摇动锥形瓶,眼睛注视 ,滴定终点现象为:
(2)下列操作中可能使所测盐酸溶液的浓度数值偏低的是___ (2分)
A.酸式滴定管未用盐酸溶液润洗就直接注入盐酸溶液
B.滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管尖嘴处在滴定前有气泡,滴定后气泡消失
D.读取氨水体积时,滴定开始时仰视读数,滴定结束时俯视读数
E. 滴定时标准液滴出锥形瓶外
Ⅱ. (10分)常温下,用0.2 mol·L-1氨水溶液滴定20ml盐酸溶液,随氨水滴加溶液PH变化如图所示,据图回答下列问题: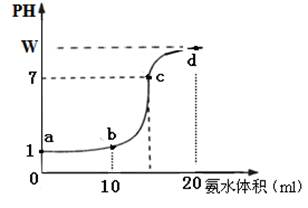
(1)该盐酸溶液的物质的量浓度为 。
(2)在c点溶液中所有离子浓度由大到小的顺序为:
(3)若正确加入指示剂,滴定终点位于曲线
A.d点 B.c点 C.a、c之间 D.d点之后
(4)a、b、c三点处溶液中,水电离出的氢离子浓度由大到小顺序为 。
(用a、b、c表示)
(5)写出d点溶液中c(NH3·H2O)的精确表达式
mol·L-1 (混合溶液总体积等于两溶液体积之和)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com