
题目列表(包括答案和解析)
某研究性学习小组探究下列化学反应的特征:
(Ⅰ)KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
(Ⅱ)FeS+HNO3→Fe(NO3)3+Fe2(SO4)3+NO2↑+N2O4↑+NO↑+H2O
(Ⅲ)CuSO4→CuO+SO3↑+SO2↑+O2↑
(Ⅳ)CO2+KOH→KHCO3+K2CO3+H2O
(1)大多数化学反应中物质的化学计量数之比是固定的,但上述化学反应的化学计量数之比是不确定的,即物质的化学计量数有多组.根据上述实例,请用一句话归纳化学计量数有多组的化学反应的特点:________.
(2)反应(Ⅱ)中还原产物是________,若其物质的量之比确定,该反应的化学计量数也随之确定.
(3)有人认为反应(Ⅲ)是两个反应式加合的结果,请分析它是哪两个化学反应加合而成的:________、________.在反应(Ⅲ)中,根据电子转移守恒,物质________和________的物质的量之比是固定的.
(4)若将16gCuSO4固体粉末按反应(Ⅲ)完全分解,最终气体产物的物质的量的取值范围是:________.
(5)若反应(Ⅳ)中KHCO3、K2CO3的化学计量数分别为a、b,则用a、b表示该反应的化学计量数的化学方程式是________.
(8分)现有①KMnO4 ②H2 ③O2 ④CL2 ⑤CO ⑥AL 六种物质,从氧化性、还原性的角度分类,若将常用的氧化剂放入甲:_____ 中,常用的还原剂放入乙:_____中,则:
⑴甲中有 ;乙中有 。(填序号)
⑵由Fe  Fe3O4
,Fe2O3
Fe3O4
,Fe2O3
 Fe 可知,欲实现I反应过程应从___________
(填“甲”或“乙”,下同)中找物质,欲实现II反应过程应从 中找物质。
Fe 可知,欲实现I反应过程应从___________
(填“甲”或“乙”,下同)中找物质,欲实现II反应过程应从 中找物质。
⑶请将4种物质:Fe、Fe2O3、CO、CO2分别填入下面对应的横线上,组成一个配平了的化学方程式,并标出电子转移的方向和数目。(提示:反应物是Fe2O3和3 CO )

 +
=====
+
+
=====
+
⑷一氧化氮是工业制硝酸的中间产物,生成一氧化氮的化学方程式为:
4X+5O2 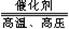 4NO+6H2O,则根据质量守恒定律可以推出X的化学式为
。
4NO+6H2O,则根据质量守恒定律可以推出X的化学式为
。
现有①KMnO4 ②H2 ③O2 ④CL2 ⑤CO ⑥AL 六种物质,从氧化性、还原性的角度分类,若将常用的氧化剂放入甲:![]() 中,常用的还原剂放入乙:
中,常用的还原剂放入乙:![]() 中,则:
中,则:
⑴甲中有 ;乙中有 。(填序号)
⑵由Fe ![]() Fe3O4 ,Fe2O3
Fe3O4 ,Fe2O3 ![]() Fe 可知,欲实现I反应过程应从 (填“甲”或“乙”,下同)中找物质,欲实现II反应过程应从 中找物质。
Fe 可知,欲实现I反应过程应从 (填“甲”或“乙”,下同)中找物质,欲实现II反应过程应从 中找物质。
⑶请将4种物质:Fe、Fe2O3、CO、CO2分别填入下面对应的横线上,组成一个配平了的化学方程式,并标出电子转移的方向和数目。
+ ===== +
⑷一氧化氮是工业制硝酸的中间产物,生成一氧化氮的化学方程式为:
4X+5O2 ![]() 4NO+6H2O,则根据质量守恒定律可以推出X的化学式为 。
4NO+6H2O,则根据质量守恒定律可以推出X的化学式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com