
题目列表(包括答案和解析)
尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l) △H2
H2O+ H2NCONH2(l) △H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。

已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定, 总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变, 固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
|
温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强/Kpa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度/10-3mol/L |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡状态的标志是____________。
A.2V(NH3)=V(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0°C时该分解反应的平衡常数为______(保留小数点后一位)。
(3)已知:
N2(g)+O2(g)=2NO(g) △H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g) △H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g) △H3=-483.6KJ/mol
则4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)的△H=___kJ • mol-1。
(4)尿素燃料电池的结构如图所示。其工作时 负极电极反应式可表示为______。

尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l) △H2
H2O+ H2NCONH2(l) △H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。

①已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定,总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变, 固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
|
温度/℃ |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强/Kpa |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度/10-3mol/L |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡状态的标志是____________。
A.2V(NH3)=V(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0°C时该分解反应的平衡常数为______(保留小数点后一位)。
(3)已知:
N2(g)+O2(g)=2NO(g) △H1=+180.6KJ/mol
N2(g)+3H2(g)=2NH3(g) △H2=-92.4KJ/mol
2H2(g)+O2(g)=2H2O(g) △H3=-483.6KJ/mol
则4NO(g)+4NH3(g) +O2(g)= 4N2(g)+6 H2O(g)的△H=___kJ • mol-1。
(4)尿素燃料电池的结构如图所示。其工作时 负极电极反应式可表示为______。

尿素(H2NCONH2)是有机态氮肥,在农业生产中有着非常重要的作用。
(1)工业上合成尿素的反应分两步进行:
第一步:2NH3(l)+CO2 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4 (l)  H2O+ H2NCONH2(l)△H2
H2O+ H2NCONH2(l)△H2
某化学学习小组模拟工业上合成尿素的条件,在体积为1 L的密闭容器中投入4 mol NH3和1 mol CO2,实验测得反应中各组分的物质的量随时间的变化如下图I所示。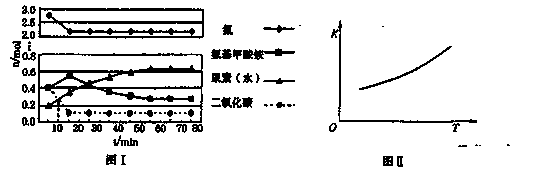
已知总反应的快慢是由较慢的一步反应决定的。则合成尿素总反应的快慢由第______步反应决定, 总反应进行到______min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上右图II所示,则ΔH2______0(填“>”、“<”或“=”。)
(2)该小组将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/Kpa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1 H2O+ H2NCONH2(l)△H2
H2O+ H2NCONH2(l)△H2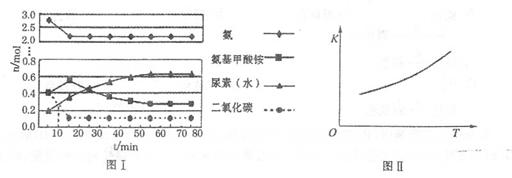
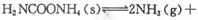
 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/Kpa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

材料1 向可溶性铝盐溶液中加入氨水,会生成白色的胶状氢氧化铝沉淀,该沉淀既可溶于强酸之中,又可溶于强碱之中,因此是一种两性氢氧化物。有人认为,氢氧化铝之所以具有两性,原因是在水中存在下列酸式电离和碱式电离的有关平衡:H++![]() +H2O
+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH-。
Al3++3OH-。
材料2 在共价键中有一种价键与一般的形成方式不同,即一方(设为A方)提供两个电子,另一方(设为B方)具有接受两个电子的空轨道,从而形成如下一种特殊化学键:A→B。这样的共价键叫做配位键。如![]() 和H3O+中各有一个共价键是配位键,用“→”表示,箭头指向没提供电子的原子。即:
和H3O+中各有一个共价键是配位键,用“→”表示,箭头指向没提供电子的原子。即:

同共价键一样,配位键可以存在于分子之中(如H2SO4、AlCl3等),也可以存在于离子之中(如![]() )。
)。

材料3 已知气态氯化铝分子以双聚形式存在,其中Al—Cl键为共价键,其结构式如上图中间结构所示。图中“Cl→Al”表示Cl原子提供了一对电子与Al原子共享。又已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却只是一元酸。
(1)通过对有关信息的学习,你对于硼酸只是一元酸是怎样认识的?
你可以通过硼酸在水溶液中的电离平衡,来解释它只是一元酸的原因。你能写出下面方程式右端的两种离子的表达式吗?

(2)你对于材料1中氢氧化铝的有关电离方式是怎样认识的?你完全认可吗?如果不认可,你能写出你认为的铝酸的电离方程式吗?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com