
题目列表(包括答案和解析)

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度/g/100g水 | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
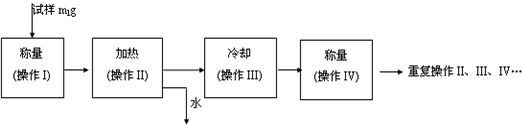
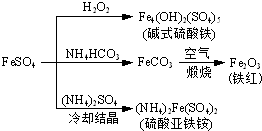 (2013?江苏三模)硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示).下列说法错误的是( )
(2013?江苏三模)硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示).下列说法错误的是( )湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com